
| A. | 反應后的固體混合物中還含有碳 | |
| B. | 反應后的固體混合物總質量為14.4 g | |
| C. | 反應后的固體混合物中單質Cu的質量為12.8 g | |
| D. | 反應后的固體混合物中氧化物的物質的量為0.05 mol |
分析 反應得到混合氣體與通過足量的澄清石灰水,反應一段時間后共收集到1.12L氣體(標準狀況)為CO的體積,生成沉淀的質量為5.00g為碳酸鈣,據此計算CO、二氧化碳的物質的量,反應后的固體混合物含有Cu、Cu2O,可能含有碳,
A.根據碳原子守恒計算參加反應的C的質量,進而確定碳是否完全反應來解答;
B.反應后固體混合物總質量=原固體混合物總質量-生成CO2與CO的總質量;
C.假設CuO完全被還原為Cu,根據Cu守恒計算生成Cu的質量,由產物中CO2、CO中的O原子守恒計算氧化銅失去氧的質量,進而計算CuO反應后的總質量,與Cu的質量比較判斷;
D.Cu2O、CuO均含有1個氧原子,根據剩余的氧原子質量計算,剩余氧原子質量=CuO反應后的總質量-Cu元素的質量.
解答 解:由題意可知,生成的n(CO2)=n(CaCO3)=$\frac{5.00g}{100g/mol}$=0.05mol,n(CO)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
A.生成的n(CO2)=n(CaCO3)=$\frac{5.00g}{100g/mol}$=0.05mol,n(CO)=$\frac{1.12L}{22.4L/mol}$=0.05mol,根據C守恒可知,參加反應的C的質量=(0.05mol+0.05mol)×12g/mol=1.2g,故還有2g-1.2g=0.8g碳未參與反應,故A正確;
B.反應后固體總質量=16g+2g-0.05mol×(44g/mol+28g/mol)=14.4g,故B正確;
C.假設CuO完全被還原為Cu,根據Cu守恒生成Cu的質量=$\frac{16g}{80g/mol}$×64g/mol=12.8g,由產物中CO2、CO中的O原子守恒可知失去氧的質量=(0.05mol×2+0.05mol)×16g/mol=2.4g,故CuO反應后的總質量=16g-2.4g=13.6g,故反應后固體中Cu的質量小于12.8g,故C錯誤;
D.反應后m(O)=13.6g-12.8g=0.8g,Cu2O、CuO均含有1個氧原子,根據氧原子守恒可知反應后的固體混合物中氧化物的物質的量=$\frac{0.8g}{16g/mol}$=0.05 mol,故D正確,
故選C.
點評 本題考查混合物計算,為高頻考點,側重對解題方法技巧與思維能力的考查,注意利用守恒思想進行解答,難度較大.


科目:高中化學 來源: 題型:選擇題
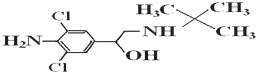
| A. | 摩爾質量為313.5g | |
| B. | 屬于芳香烴類化合物 | |
| C. | 瘦肉精的分子式為C12H17Cl2N2O | |
| D. | 可發生加成反應、取代反應、消去反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 治理“地溝油”,可通過水解反應制得肥皂 | |
| B. | 硅晶體具有半導體性能,可用于制取光導纖維 | |
| C. | 人類超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因 | |
| D. | PM2.5是指空氣中直徑≤2.5 μm的顆粒物,直徑為2.5 μm的顆粒物分散在空氣中形成膠體(1μm=10-6m) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | 硅酸鈉溶液與醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| C. | AlCl3溶液中加入過量的氨水:Al3++4OH-=AlO2-+2H2O | |
| D. | 向NaHCO3溶液中加入過量Ca(OH)2溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 食鹽可作調味劑,也可作食品防腐劑 | |
| B. | 小蘇打是一種膨松劑,可用于制作饅頭和面包 | |
| C. | 煤經過氣化和液化等物理變化可以轉化為清潔燃料 | |
| D. | 次氯酸鈉溶液可用于環境的消毒殺菌 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 對太陽光進行光譜分析,可證明太陽上是否含有Ar元素 | |
| B. | 利用焰色反應鑒別NaCl和KCl兩種溶液 | |
| C. | 利用石灰水鑒別純堿和小蘇打兩種溶液 | |
| D. | 利用燒堿溶液鑒別MgCl2和AlCl3兩種溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
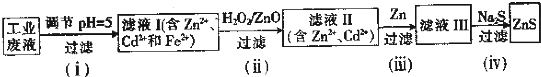
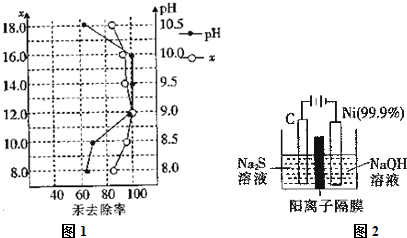
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com