

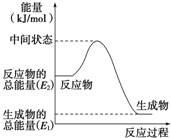
分析 (1)探究化學反應中的能量變化時,溫度升高,則反應放熱;溫度降低則反應吸熱;吸熱反應反應物總能量低于生成物,據此分析;
(2)能設計成原電池的反應必須是自發進行的放熱的氧化還原反應.
解答 解:(1)通過實驗測出,反應前后a燒杯中的溫度升高,b燒杯中的溫度降低,根據溫度升高,反應放熱,溫度降低,反應吸熱,所以Al跟鹽酸的反應是放熱反應,b是吸熱反應,反應物總能量低于生成物,故答案為:放;低于;
(2)①氫氧化鈉與硫酸反應,該反應不是氧化還原反應,所以不能設計成原電池,故錯誤;
②一氧化碳與氧氣反應,該反應是放熱反應且是自發的氧化還原反應,所以能設計成原電池,故正確;
③八水合氫氧化鋇與氯化銨反應,該反應是吸熱反應,所以不能設計成原電池,故錯誤;
④金屬銅與硝酸銀反應,該反應是放熱反應且是自發的氧化還原反應,所以能設計成原電池,故正確,
故答案為:②④.
點評 本題考查化學反應與能量變化,為高頻考點,學生根據實驗現象判斷放熱與吸熱反應、原電池原理,注意放熱反應反應物總能量高于生成物,斷鍵吸收能量少于成鍵放出能量,題目難度不大.


 亮點激活精編提優100分大試卷系列答案
亮點激活精編提優100分大試卷系列答案科目:高中化學 來源:2017屆廣東省山一高三上第二次統測化學試卷(解析版) 題型:實驗題
NaCl和NaClO在酸性條件下可發生反應:ClO- + Cl- + 2H+ = Cl2↑+ H2O,某學習小組擬研究消毒液(主要成分為NaCl和NaClO)的變質情況。
(1)此消毒液中NaClO可吸收空氣中的CO2生成NaHCO3和HClO而變質。寫出此化學反應方程式 。
(2)取適量消毒液放在試管中,加入足量一定濃度的硫酸,有氣體放出。通過以下裝置檢驗氣體的成分可以判斷消毒液的變質情況。
限選試劑為:98%濃硫酸、1%品紅溶液、1.0 mol·L-1 KI-淀粉溶液、1.0 mol·L-1NaOH、
澄清石灰水、飽和NaCl溶液
請完成下列探究實驗方案。
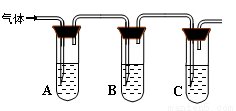
所加試劑 | 預期現象和結論 |
試管A中加足量① ; 試管B中加1%品紅溶液; 試管C中加② 。 | 若A中溶液變藍色,B中溶液不褪色,C中溶液變渾濁。則消毒液部分變質; ③ 則消毒液未變質; ④ 則消毒液完全變質。 |
(3)用滴定法測定消毒液中NaClO的濃度。實驗步驟如下:
① 量取 25.00 mL消毒液放入錐形瓶中,加入過量的a mol·L-1 Na2SO3溶液b mL;
② 滴定分析。將c mol·L-1的酸性KMnO4溶液裝入 (填酸式或堿式)滴定管中;KMnO4和剩余的Na2SO3發生反應。當溶液由無色變成淺紅色,且保持半分鐘內紅色不褪時,停止滴定,記錄數據。重復滴定實驗2次,平均消耗酸性KMnO4溶液v mL;
滴定過程中涉及的反應有:NaClO+Na2SO3=NaCl+Na2SO4;
2KMnO4+5Na2SO3+3H2SO4=K2SO4+2MnSO4+5Na2SO4+3H2O
③ 計算消毒液中NaC lO的濃度為 mol·L-1(用含a、b、c、v的代數式表示)。
lO的濃度為 mol·L-1(用含a、b、c、v的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
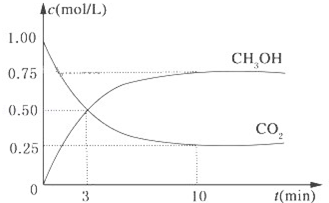 降低大氣中CO2的含量及有效地開發利用 CO2,目前工業上有一種方法是用CO2來生產燃料甲醇.為探究反應原理,現進行如下實驗,在體積為1L的恒容密閉容器中,充入1mol CO2和3mol H2,一定條件下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.測得CO2和CH3OH(g)的濃度隨時間變化如圖所示.
降低大氣中CO2的含量及有效地開發利用 CO2,目前工業上有一種方法是用CO2來生產燃料甲醇.為探究反應原理,現進行如下實驗,在體積為1L的恒容密閉容器中,充入1mol CO2和3mol H2,一定條件下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.測得CO2和CH3OH(g)的濃度隨時間變化如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 銅與濃硫酸反應生成的白色固體是CuSO4 | |
| B. | ①中灰白色固體不可能含有CuO | |
| C. | ②中的黑色固體可能含有CuS或Cu2S | |
| D. | ④中所得的白色沉淀是BaSO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 甲醇是人們開發和利用的一種新能源.已知:
甲醇是人們開發和利用的一種新能源.已知:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | O2通入正極區 | |
| B. | 總反應為:2H2+O2═2H2O | |
| C. | 正極發生氧化反應 | |
| D. | 負極區電極反應為 2H2+4OH--4e-═4H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水的離子積常數KW | B. | 可逆反應的平衡常數K | ||
| C. | 0.1mol/LCH3COONa溶液的pH | D. | NH3•H2O的電離常數Kb |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com