

| 反應 | △H/kJ•mol-1 | △S/J•K-1•mol-1 |
| ① | -72.1 | +220 |
| ② | +149 | +41 |
分析 鈦鐵礦(主要成分為FeTiO3,含少量Fe2O3)制備鈦,鈦鐵礦加入過量焦炭在高溫下還原生成鐵和粗TiO2,加入過量焦炭在高溫下氯化反應生成TiCl4,加入還原劑還原生成金屬鈦,酸洗后得到海綿鈦;
(1)增大接觸面積加快反應速率;
(2)步驟Ⅰ中所發生的主要反應是FeTiO3在高溫下被碳還原生成二氧化鈦、鐵,碳被氧化為一氧化碳;
(3)步驟Ⅱ中所發生的主要反應是二氧化鈦和氯氣、碳高溫發生氧化還原反應生成四氯化鈦和一氧化碳,加入焦炭后發生反應①,與反應②相比,△H減小,△S增大;
(4)TiCl4遇到水易發生水解,用鹽酸洗滌粗Ti,除去表面的雜質;
(5)依據平衡常數的概念結合反應寫出計算式計算平衡濃度得到;
(6)電解池的陰極上得電子反應還原反應生成金屬鈦.
解答 解:鈦鐵礦(主要成分為FeTiO3,含少量Fe2O3)制備鈦,鈦鐵礦加入過量焦炭在高溫下還原生成鐵和粗TiO2,加入過量焦炭在高溫下氯化反應生成TiCl4,加入還原劑還原生成金屬鈦,酸洗后得到海綿鈦;
(1)進行步驟Ⅰ前,鈦鐵礦需要先粉碎成細顆粒,目的為增大接觸面積增大反應速率,故答案為:增大反應速率;
(2)步驟Ⅰ中所發生的主要反應是FeTiO3在高溫下被碳還原生成二氧化鈦、鐵,碳被氧化為一氧化碳,反應的化學方程式為:FeTiO3+C$\frac{\underline{\;1180℃-1200℃\;}}{\;}$ Fe+TiO2+CO↑;
故答案為:FeTiO3+C$\frac{\underline{\;1180℃-1200℃\;}}{\;}$ Fe+TiO2+CO↑;
(3)步驟Ⅱ中所發生的主要反應是二氧化鈦和氯氣、碳高溫發生氧化還原反應生成四氯化鈦和一氧化碳,①的化學方程式為:TiO2+2Cl2+2C $\frac{\underline{\;800℃-900℃\;}}{\;}$ TiCl4+2CO,圖表數據分析可知加入焦炭后發生反應①,與反應②相比,△H減小,△S增大,更有利于反應在較低溫度下向右進行,
故答案為:TiO2+2Cl2+2C $\frac{\underline{\;800℃-900℃\;}}{\;}$ TiCl4+2CO;加入焦炭后發生反應①,與反應②相比,△H減小,△S增大,更有利于反應在較低溫度下向右進行;
(4)步驟Ⅲ中,反應物TiCl4應避免接觸水,原因為防止TiCl4水解,反應結束后,用鹽酸洗滌粗Ti,除去Mg、MgCl2等雜質,制得海綿鈦,
故答案為:防止TiCl4水解;Mg、MgCl2;
(5)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.79×10-39,反應Fe (OH)3+3H+?Fe3++H2O的平衡常數K=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=$\frac{c(F{e}^{3+})}{(\frac{1{0}^{-14}}{c(O{H}^{-})})^{3}}$=c(Fe3+)×c3(OH-)×1042=2.79×10-39×1042=2.79×103,故答案為:2.79×103;
(6)電解時,陰極上得電子發生還原反應,電極反應式為TiO2+4e-=Ti+2O2-,陽極上是氧離子失電子發生氧化反應產生氧氣,電極反應為2O2--4e-=O2,
故答案為:TiO2+4e-=Ti+2O2-.
點評 本題考查學生閱讀題目獲取信息能力、氧化還原反應、綠色化學、膠體、物質分離提純,平衡常數計算,溶度積常數的計算應用,蓋斯定律的計算應用等,難度中等,注意基礎知識的掌握利用.


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
 一定溫度下,向容積為2L的恒容密閉容器中充入6mol CO2和8mol H2,發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,測得n(H2)隨時間變化如曲線Ⅰ所示.下列說法正確的是( )
一定溫度下,向容積為2L的恒容密閉容器中充入6mol CO2和8mol H2,發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,測得n(H2)隨時間變化如曲線Ⅰ所示.下列說法正確的是( )| A. | 該反應在0~8 min內CO2的平均反應速率是 0.375 mol•L-1•min-1 | |
| B. | 若起始時向上述容器中充入3 mol CO2和4 mol H2,則平衡時H2的體積分數大于20% | |
| C. | 若起始時向上述容器中充入4 mol CO2、2 mol H2、2 mol CH3OH和1mol H2O(g),則此時反應向正反應方向進行 | |
| D. | 改變條件得到曲線Ⅱ、Ⅲ,則曲線Ⅱ、Ⅲ改變的條件分別是升高溫度、充入氦氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,11.2LSO3所含的原子數為1.5NA | |
| B. | 常溫常壓下,1.8g H2O中含有的電子數為0.8NA | |
| C. | 常溫常壓下,48g O2和O3的混合物中含有的氧原子數為3NA | |
| D. | 標準狀況下,0.1mol Cl2與足量NaOH溶液反應時,轉移的電子數為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
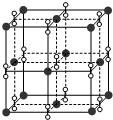
| A. | KO2 | B. | K2O2 | C. | K2O3 | D. | K2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com