
 已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1
已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1| SO2Cl2 | Cl2 | SO2 | |
| 熔點/℃ | -54.1 | -101 | -72.4 |
| 沸點/℃ | 69.1 | -34.6 | -10 |
| 性質 | 遇水發生劇烈水解 | / | / |
分析 (1)由①SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1
②SO2Cl2(l)+SCl2(g)?2SOCl2(g)△H=﹢b kJ•mol-1
結合蓋斯定律可知,①-②得到SO2(g)+Cl2(g)?SO2Cl2(g),K為生成物濃度冪之積與反應物濃度冪之積的比;
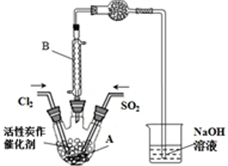
(2)①B為冷凝管,圖中無加熱裝置,可知該反應為放熱反應,干燥管可防止水蒸氣進入A中;
②濃鹽酸與高錳酸鉀為原料制取Cl2,生成氯化鉀、氯化錳、氯氣和水;
③為放熱反應,降溫溫度平衡正向移動;結合表格數據可知,混合物沸點不同;
④SO2Cl2與NaOH溶液反應,為非氧化還原反應,生成硫酸鈉、氯化鈉和水;
⑤n(Cl2)=$\frac{0.896L}{22.4L/mol}$=0.04mol,由SO2(g)+Cl2(g)?SO2Cl2(g)可知,理論生成SO2Cl2為0.04mol×135g/mol=5.4g,以此計算產率.
解答 解:(1)由①SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1
②SO2Cl2(l)+SCl2(g)?2SOCl2(g)△H=﹢b kJ•mol-1
結合蓋斯定律可知,①-②得到SO2(g)+Cl2(g)?SO2Cl2(g),
則△H=(-a-b)kJ•mol-1,該反應平衡常數表達式為K=$\frac{c(S{O}_{2}C{l}_{2})}{c(S{O}_{2})c(C{l}_{2})}$,
故答案為:(-a-b)kJ•mol-1;$\frac{c(S{O}_{2}C{l}_{2})}{c(S{O}_{2})c(C{l}_{2})}$;
(2)①B儀器在本實驗中的作用是冷凝SO2Cl2(或使揮發的產物SO2Cl2冷凝),圖中無加熱裝置,反應可持續發生,可知該反應為放熱反應,干燥管的作用是防止水蒸氣進入A與SO2Cl2發生水解反應,吸收SO2和Cl2氣體,防止污染空氣,
故答案為:冷凝SO2Cl2(或使揮發的產物SO2Cl2冷凝);放;防止水蒸氣進入A與SO2Cl2發生水解反應,吸收SO2和Cl2氣體,防止污染空氣;
②用濃鹽酸與高錳酸鉀為原料制取Cl2,則反應的離子方程式為2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案為:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
③為放熱反應,降溫溫度平衡正向移動,則選擇冰水浴;結合表格數據可知,混合物沸點不同,則選擇蒸餾分離,故答案為:B;G;
④SO2Cl2與NaOH溶液反應的化學方程式為SO2Cl2+4NaOH=Na2SO4+2NaCl+2H2O,故答案為:SO2Cl2+4NaOH=Na2SO4+2NaCl+2H2O;
⑤n(Cl2)=$\frac{0.896L}{22.4L/mol}$=0.04mol,由SO2(g)+Cl2(g)?SO2Cl2(g)可知,理論生成SO2Cl2為0.04mol×135g/mol=5.4g,最后得到純凈的磺酰氧3.3g,則磺酰氯的產率為$\frac{3.3g}{5.4g}$×100%=61.1%,故答案為:61.1%.
點評 本題考查物質的制備實驗及化學平衡計算,為高頻考點,把握蓋斯定律應用、制備原理、數據應用、混合物分離為解答的關鍵,側重分析與實驗能力的考查,注意氧化還原反應的應用,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 5mol,10mol | B. | 6mol,2mol | C. | 8mol,4mol | D. | 8mol,2mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、Mg2+、Cl-、SO42- | B. | Cu2+、Cl-、NO3-、OH- | ||
| C. | Ca2+、Na+、CO32-、NO3- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元 素 | M | F | |
| 電離能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔點/K | 沸點/K | 標準狀況時在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在放電時,正極發生的反應是Pb+SO42-═PbSO4+2e- | |
| B. | 在放電時,該電池的負極材料是鉛板 | |
| C. | 在充電時,電池中硫酸的濃度不斷變小 | |
| D. | 在充電時,陽極發生的反應是PbSO4+2e-═Pb+SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol CO2的質量是44g | |
| B. | 17 g NH3的體積是22.4 L | |
| C. | 100 mL 1 mol/L NaOH溶液中含有1 mol OH- | |
| D. | 標準狀況下,11.2 L O2中含有6.02×1023個氧分子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com