
| 元 素 | M | F | |
| 電離能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔點/K | 沸點/K | 標準狀況時在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |

分析 A、B、C、D、E、F都是周期表中前四周期的元素,它們的原子序數依次增大,其中A、C原子的L層有2個未成對電子,且A原子序數小于C,則A是C、C是O元素,B介于A和C元素之間,為N元素;
D與E同主族,D的二價陽離子與C的陰離子具有相同的電子層結構,則D為Mg元素;E為Ca元素,
F3+離子M層3d軌道電子為半滿狀態,F原子核外電子數為26,為Fe元素;
(1)Fe原子核外3d、4s能級電子為其價電子,根據構造原理書寫Fe原子價電子排布式;
(2)原子個數相等、電子數相等的微粒互為等電子體;C22-中成鍵原子價層電子對個數是2,根據價層電子對互斥理論判斷C原子雜化方式;
(3)F是Fe元素、M是Mn元素,原子軌道電子數處于全滿、全空、半滿時最穩定;
(4)含有氫鍵的氫化物熔沸點較高、溶解性較大;
(5)b中M原子個數=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,原子所占體積=4×$\frac{4}{3}$πRa3(nm)3,晶胞中面上3個原子共直線,則棱長=2$\sqrt{2}$Ranm,晶胞體積=(2$\sqrt{2}$Ra)3(nm)3.
解答 解:A、B、C、D、E、F都是周期表中前四周期的元素,它們的原子序數依次增大,其中A、C原子的L層有2個未成對電子,且A原子序數小于C,則A是C、C是O元素,B介于A和C元素之間,為N元素;
D與E同主族,D的二價陽離子與C的陰離子具有相同的電子層結構,則D為Mg元素;E為Ca元素,
F3+離子M層3d軌道電子為半滿狀態,F原子核外電子數為26,為Fe元素;
(1)Fe原子核外3d、4s能級電子為其價電子,根據構造原理書寫Fe原子價電子排布式為3d64s2,
故答案為:3d64s2;
(2)原子個數相等、電子數相等的微粒互為等電子體,則與A22-互為等電子體的單質是N2;C22-中成鍵原子價層電子對個數是2,根據價層電子對互斥理論判斷C原子雜化方式為sp,
故答案為:N2;sp;
(3)F是Fe元素、M是Mn元素,原子軌道電子數處于全滿、全空、半滿時最穩定,Mn2+的3d軌道電子排布為半滿狀態較穩定,所以氣態Mn2+再失去一個電子比氣態Fe2+再失去一個電子難,
故答案為:Mn2+的3d軌道電子排布為半滿狀態較穩定;
(4)含有氫鍵的氫化物熔沸點較高、溶解性較大,H2O2分子間存在氫鍵,與水分子可形成氫鍵,所以雙氧水的熔沸點和溶解性大于硫化氫,
故答案為:H2O2分子間存在氫鍵,與水分子可形成氫鍵;
(5)b中M原子個數=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,原子所占體積=4×$\frac{4}{3}$π(Ra)3(nm)3,晶胞中面上3個原子共直線,則棱長=2$\sqrt{2}$Ranm,晶胞體積=(2$\sqrt{2}$Ra)3(nm)3,其空間利用率=$\frac{4×\frac{4}{3}π(Ra)^{3}(nm)^{3}}{(2\sqrt{2}Ra)^{3}(nm)^{3}}$=$\frac{π}{3\sqrt{2}}$,
故答案為:$\frac{π}{3\sqrt{2}}$.
點評 本題考查物質結構和性質,涉及晶胞計算、氫鍵、等電子體、原子雜化方式判斷等知識點,側重考查學生分析、判斷及計算能力,難點是晶胞計算,注意(5)中每個面上對角線的3個原子緊鄰,題目難度中等.


科目:高中化學 來源: 題型:解答題

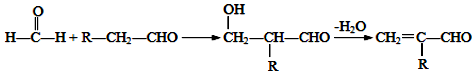
 .
.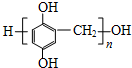 (寫出一種即可).
(寫出一種即可).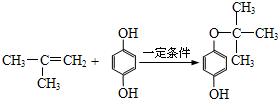 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 碳和碳的化合物在生產、生活中的應用非常廣泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一種理想,更是一種值得期待的新的生活方式.
碳和碳的化合物在生產、生活中的應用非常廣泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一種理想,更是一種值得期待的新的生活方式.| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | CO2 |
| H2O | CO | ||||
| 1 | 650 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | 2 | 0.4 | 0.4 | 1 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
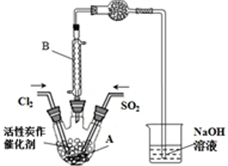 已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1
已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1| SO2Cl2 | Cl2 | SO2 | |
| 熔點/℃ | -54.1 | -101 | -72.4 |
| 沸點/℃ | 69.1 | -34.6 | -10 |
| 性質 | 遇水發生劇烈水解 | / | / |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HClO的結構式:H-Cl-O | B. | 氨氣分子的比例模型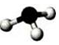 | ||
| C. | 原子核內有10個中子的氧原子:18O | D. | H2與H+互為同位素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
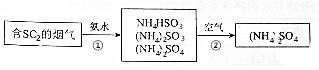 燃煤產生的煙氣中含有較多的SO2,直接排放會嚴重污染空氣.氨法脫硫是一種操作簡單、效率高的脫硫方法,其反應原理可用如圖表示.
燃煤產生的煙氣中含有較多的SO2,直接排放會嚴重污染空氣.氨法脫硫是一種操作簡單、效率高的脫硫方法,其反應原理可用如圖表示.| 離子 | NH4+ | SO32- | HSO3- | SO42- |
| 濃度(mol/L) | 1.22 | 0.55 | 0.02 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com