
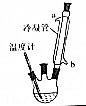
 肉桂酸乙酯具有草莓香味,用于配置香水、香精和人造精油.實驗室制備肉桂酸乙酯的反應、裝置示意圖和有關數據如下:
肉桂酸乙酯具有草莓香味,用于配置香水、香精和人造精油.實驗室制備肉桂酸乙酯的反應、裝置示意圖和有關數據如下: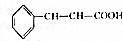 +CH3CH2OH$?_{△}^{濃硫酸}$
+CH3CH2OH$?_{△}^{濃硫酸}$ +H2O
+H2O | 相對分子質量 | 密度/(g•cm-3) | 沸點/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | 78.3 | 與水互溶 |
| 肉桂酸 | 148 | 1.245 | 300 | 微溶于水 |
| 肉桂酸乙酯 | 176 | 1.049 | 270 | 不溶于水 |

分析 (1)反應混合物要回流12h,乙醇易揮發,所以需要冷凝回流;
(2)反應后得到的混合物有未反應的乙醇和肉桂酸,根據題中提供的各物質的沸點可知,可以通過蒸餾的方法去除乙醇,制備過程中需要控制溫度在75℃,可以用水浴加熱的方式;
(3)乙醇易揮發,加入過量的乙醇,可以提高肉桂酸的轉化率;
(4)肉桂酸乙酯不溶于水,所以可以用分液的方法分離肉桂酸乙酯和水;蒸餾操作中,溫度計水銀球應與支管口平齊,冷卻水要從下口進,據此判斷;
(5)根據最終制得17.6g肉桂酸乙酯可計算出參加反應的肉桂酸的質量,肉桂酸的利用率=$\frac{參加反應的肉桂酸的質量}{起始用量}$×100%,據此計算;
解答 解:(1)反應混合物要回流12h,乙醇易揮發,需要冷凝回流,所以冷凝管的作用是冷凝回流,
故答案為:冷凝回流;
(2)反應后得到的混合物不未反應的乙醇和肉桂酸,根據題中提供的各物質的沸點可知,可以通過蒸餾的方法除去乙醇,制備過程中需要控制溫度在75℃,可以用水浴加熱的方式,
故答案為:除去乙醇;水浴加熱;
(3)乙醇易揮發,加入過量的乙醇,可以提高肉桂酸的轉化率,
故答案為:提高肉桂酸的轉化率;
(4)肉桂酸乙酯不溶于水,所以可以用分液的方法分離肉桂酸乙酯和水,所用儀器為分液漏斗,蒸餾操作中,溫度計水銀球應與支管口平齊,冷卻水要從下口進,故D裝置正確,
故答案為:分液;分液漏斗;D;
(5)根據方程式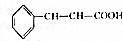 +CH3CH2OH$?_{△}^{濃硫酸}$
+CH3CH2OH$?_{△}^{濃硫酸}$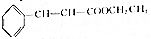 +H2O可知,制得17.6g肉桂酸乙酯,需要參加肉桂酸的質量為$\frac{148}{176}$×17.6g=14.8g,所以肉桂酸的利用率=$\frac{參加反應的肉桂酸的質量}{起始用量}$×100%=$\frac{14.8}{20}$×100%=74%,
+H2O可知,制得17.6g肉桂酸乙酯,需要參加肉桂酸的質量為$\frac{148}{176}$×17.6g=14.8g,所以肉桂酸的利用率=$\frac{參加反應的肉桂酸的質量}{起始用量}$×100%=$\frac{14.8}{20}$×100%=74%,
故答案為:74%;
點評 本題為考查了有機實驗方案的設計、混合物的分離、提純、物質利用率的計算等知識,題目難度中等,明確實驗原理是解本題關鍵,考查了學生的分析、理解能力及靈活應用所學知識的能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | Na2O2--淡黃色固體,可作漂白劑 | |
| B. | Na2O--白色固體,性質不穩定加熱可生成Na2O2 | |
| C. | NaCl--用于調味,醫療上作生理鹽水 | |
| D. | Na2CO3--性質穩定,可用于治療胃酸過多 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 表面附著氨水的碳素鋼在空氣中主要發生析氫腐蝕 | |
| B. | 反應NH3(g)+HCl(g)?NH4Cl (s)的△H<0,△S<0 | |
| C. | 25℃時,pH=11的氨水與pH=3的鹽酸等體積混合,所得溶液的pH>7 | |
| D. | 向2NH3(g)?N2(g)+3H2(g)的平衡體系中加入催化劑,NH3的平衡轉化率增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學式 | CH3COOH | HA | HNO2 | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{2a-4b}{V}$ | B. | $\frac{2(a-b)}{V}$ | C. | $\frac{a-2b}{V}$ | D. | $\frac{2a-b}{V}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com