
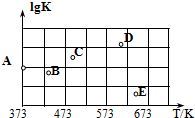
 ,乙苯脫氫反應的平衡常數K如表所示;在體積為1 L的恒容密閉容器中充入0.2 mol乙苯蒸汽,在不同溫度下進行乙苯脫氫反應.
,乙苯脫氫反應的平衡常數K如表所示;在體積為1 L的恒容密閉容器中充入0.2 mol乙苯蒸汽,在不同溫度下進行乙苯脫氫反應.| T/K | 700 | 800 | 900 | 1 000 | 1 100 |
| K | 3.3×10-2 | 4.71×10-2 | 0.10 | 2.00 | 7.87 |
| A. | 乙苯脫氫反應是放熱反應 | |
| B. | 800℃下達到平衡時,苯乙烯的體積分數為40% | |
| C. | 900℃下達到平衡時,乙苯的轉化率為50% | |
| D. | 1 000℃下達到平衡時,H2的濃度為0.075 mol•L-1 |
分析 由表中數據可知,溫度越高,平衡常數越大,根據溫度對平衡移動設參加反應的影響分析;
設乙苯轉化了xmol/L
 ,
,
起始濃度(mol/L):0.2 0 0
轉化濃度(mol/L):x x x
平衡濃度(mol/L):0.2-x x x
平衡常數K=$\frac{c({H}_{2})×c(苯乙烯)}{c(乙苯)}$,結合不同溫度下的平衡常數計算.
解答 解:A.由表中數據可知,溫度越高,平衡常數越大,說明升高溫度平衡向正方向移動,則正方向為吸熱反應,故A錯誤;
B.800℃時,K=4.71×10-2,設乙苯轉化率xmol/L
 ,
,
起始濃度(mol/L):0.2 0 0
轉化濃度(mol/L):x x x
平衡濃度(mol/L):0.2-x x x
若苯乙烯的體積分數為40%,則$\frac{x}{0.2-x+x+x}$=0.4,解得x=0.13,此溫度的K=$\frac{c({H}_{2})×c(苯乙烯)}{c(乙苯)}$=$\frac{0.13×0.13}{0.2-0.13}$≠4.71×10-2,故B錯誤;
C、同理900℃,K=0.1,時,設乙苯轉化率xmol/L 則K=$\frac{{x}^{2}}{0.2-x}$=0.1,解得x=0.1,則乙苯的轉化率為$\frac{0.1}{0.2}×100%$=50%,故C正確;
D、同理1000℃時,K=2,若達到平衡時,H2的濃度為0.075 mol•L-1,則
 ,
,
平衡濃度(mol/L):0.2-0.075 0.075 0.075
則化學平衡常數K=$\frac{0.07{5}^{2}}{0.2-0.075}$≠2,故D錯誤;
故選C.
點評 本題的知識點為運用不同溫度下的平衡常數進行計算,題目難度不大,但是計算量較大,注意運用技巧,可以逆反思維計算.


 寒假學與練系列答案
寒假學與練系列答案科目:高中化學 來源: 題型:選擇題
| A. | Fe+2HCl═FeCl2+H2↑ | |
| B. | 2HCl+Ca(ClO)2═2HClO+CaCl2 | |
| C. | I2+2NaClO3═2NaIO3+Cl2↑ | |
| D. | 4HCl(濃)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氯化亞砜用于醫藥、農藥、染料工業及有機合成工業,常作氯化劑,制鋰氯化亞砜(Li/SOCl2)電池.工業上用SO2、SCl2與Cl2反應合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).
氯化亞砜用于醫藥、農藥、染料工業及有機合成工業,常作氯化劑,制鋰氯化亞砜(Li/SOCl2)電池.工業上用SO2、SCl2與Cl2反應合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 據報道,一定條件下 Fe2O3可被甲烷還原為“納米級”的金屬鐵.其反應為:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)
據報道,一定條件下 Fe2O3可被甲烷還原為“納米級”的金屬鐵.其反應為:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
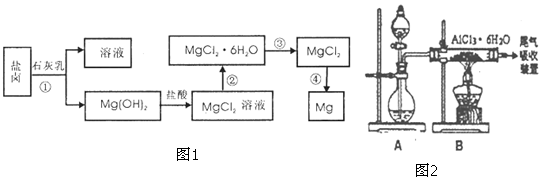
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com