
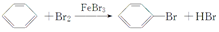
 氯化亞砜用于醫(yī)藥、農藥、染料工業(yè)及有機合成工業(yè),常作氯化劑,制鋰氯化亞砜(Li/SOCl2)電池.工業(yè)上用SO2、SCl2與Cl2反應合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).
氯化亞砜用于醫(yī)藥、農藥、染料工業(yè)及有機合成工業(yè),常作氯化劑,制鋰氯化亞砜(Li/SOCl2)電池.工業(yè)上用SO2、SCl2與Cl2反應合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
分析 (1)①根據溫度對化學平衡的影響考慮;
②向2L的密閉容器中通入SO2、SCl2與Cl2均為0.04mol,設參與反應的為SO2為x,列三段式,根據溫度相同、體積相同,氣體的物質的量之比=氣體的壓強之比,解得x,再由v=$\frac{△c}{△t}$計算;
③II與Ⅰ比較,反應速率加快,但平衡狀態(tài)一樣,應為使用催化劑;
(2)①根據化學平衡常數為生成物濃度冪之積與反應物濃度冪之積之比計算;
②根據溫度對化學平衡的影響結合對數可得;
(3)由△H=反應物的總鍵能-生成物的總鍵能計算可得;
(4)正極得電子發(fā)生還原反應,結合總反應產物可得正極電極反應式;陽離子移向正極.
解答 解:(1)①升高溫度,K值減小,該反應為放熱反應,該反應的△H<0,故答案為:<;
②向2L的密閉容器中通入SO2、SCl2與Cl2均為0.04mol,設參與反應的為SO2為x,則:
SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)
n始:0.04 0.04 0.04 0
n轉:x x x 2x
n平:0.04-x 0.04-x 0.04-x 2x
由表可知,4min達到平衡,溫度相同、體積相同,氣體的物質的量之比=氣體的壓強之比,則 $\frac{{p}_{平}}{{p}_{始}}$=$\frac{0.12-x}{0.12}$=$\frac{5.0p0}{6.0p0}$,解得x=0.02mol,則反應開始至達到平衡時,v(SOCl2)=$\frac{0.02mol×2÷2L}{4min}$=0.005mol/(L•min);
故答案為:0.005mol/(L•min);
③II與Ⅰ比較,達到平衡所用時間段,說明反應速率加快,但平衡狀態(tài)一樣,應為使用催化劑;
故答案為:使用催化劑;
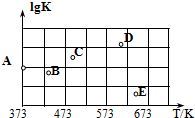
(2)①根據(1)可知,373K時:
SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)
c平:0.01 0.01 0.01 0.02
則化學平衡常數K=$\frac{0.0{2}^{2}}{0.0{1}^{3}}$=400,則A點的數值為lgK=lg400=2.6;
故答案為:2.6
②該反應為放熱反應,升高溫度,K值減小,lgK減小,故A可能變化為B、E兩點;
故答案為:BE;
(3)反應S4(g)+4Cl2(g)═4SCl2(g)的△H=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化學鍵斷裂時分別需要吸收1064kJ、510kJ的能量,設1molCl2(g)分子中化學鍵斷裂時需吸收的能量為Q,則△H=1064+4×Q-4×510=-4,解得Q=243;
故答案為:243;
(4)正極得電子發(fā)生還原反應,結正極電極反應式為:2SOCl2+4e-=S+SO2↑+4Cl-;陽離子移向正極,所以電解質中鋰離子移向正極,
故答案為:2SOCl2+4e-=S+SO2↑+4Cl-;正極.
點評 本題考查了化學平衡的有關計算,溫度對化學平衡的影響,鍵能與反應熱的關系以及原電池的原理,綜合性強,題目難度不大,考生注意基礎知識的把握與計算.


 金牌教輔培優(yōu)優(yōu)選卷期末沖刺100分系列答案
金牌教輔培優(yōu)優(yōu)選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Al2(SO4)3═2Al3++3SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2O═O2-+2H+ | D. | Na2CO3═Na2++CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 ,
,查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 ,乙苯脫氫反應的平衡常數K如表所示;在體積為1 L的恒容密閉容器中充入0.2 mol乙苯蒸汽,在不同溫度下進行乙苯脫氫反應.
,乙苯脫氫反應的平衡常數K如表所示;在體積為1 L的恒容密閉容器中充入0.2 mol乙苯蒸汽,在不同溫度下進行乙苯脫氫反應.| T/K | 700 | 800 | 900 | 1 000 | 1 100 |
| K | 3.3×10-2 | 4.71×10-2 | 0.10 | 2.00 | 7.87 |
| A. | 乙苯脫氫反應是放熱反應 | |
| B. | 800℃下達到平衡時,苯乙烯的體積分數為40% | |
| C. | 900℃下達到平衡時,乙苯的轉化率為50% | |
| D. | 1 000℃下達到平衡時,H2的濃度為0.075 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 碳氧化物研究
碳氧化物研究| CO的轉化率 T(℃) | 10min | 20min | 30min | 40min |
| T1 | 20% | 55% | 65% | 65% |
| T2 | 35% | 50% | a1 | a2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 第二個反應的平衡常數為1 | |
| B. | 第二個反應的平衡常數為0.05 | |
| C. | 第二個反應達到平衡時,H2的平衡濃度為0.25mol/L | |
| D. | 第二個反應達到平衡時,HI(g)的平衡濃度為0.25 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
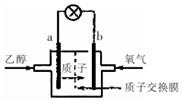 乙醇燃料電池中采用磺酸類質子溶劑,在200℃左右時供電,電池總反應為:
乙醇燃料電池中采用磺酸類質子溶劑,在200℃左右時供電,電池總反應為:| A. | 電池工作時.質子向電池的負極遷移 | |
| B. | 電池工作時.電子由b極沿導線流向a極 | |
| C. | a極上發(fā)生的電極反應是:C2H5OH+3H2O+12e一=2CO2+12H+ | |
| D. | -b極上發(fā)生的電極反應是:4H++O2+4e一=2H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com