

| 溫度/℃ | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
分析 (1)在恒溫恒容的條件下,欲提高CH4的反應速率和轉化率,改變條件平衡向正反應方向移動,且反應速率加快,結合外界條件對反應速率、平衡移動影響分析;
(2)平衡常數只受溫度影響,與反應物的濃度無關;
令開始H2O和CO的物質的量都是1mol,某一時刻時CO和CO2的濃度比為1:3,計算此時參加反應的CO的物質的量,利用三段式計算此時各組分的濃度,反應氣體氣體的體積不變,利用物質的量代替濃度計算此時的濃度商Qc,與平衡常數比較判斷反應進行分析,據此解答;
(3)A.固氮指由游離態的氮轉化為化合態的氮;
B.催化劑加快反應速率,不能影響平衡移動;
C.合成氨反應溫度控制在500℃左右,在該溫度下反應速率較快、催化劑活性較高;
D.合成氨工業采用循環操作,目的是提高原料的利用率;
(4)根據尿素的化學式,結合C、N原子守恒判斷生產尿素過程中,理論上n(NH3):n(CO2)的最佳配比;
有利于提高CO2的轉化率,NH3極易溶于水,便于分離、回收利用;
(5)根據關系式CH4~CO~3H2計算造合成氣的反應中生成的CO、H2的體積,根據關系式 CO~H2計算分離二氧化碳過程生成的H2體積,兩部分氫氣體積為生成氫氣的總體積,再根據 3H2~2NH3計算生成氨氣的體積.
解答 解:(1)A、增大壓強,反應速率加快,平衡向逆反應方向移動,甲烷的轉化率降低,故A錯誤;
B、升高溫度,反應速率加快,平衡向正反應方向移動,甲烷的轉化率增大,故B正確;
C、充入He氣,反應混合物的濃度不變,反應速率不變,平衡不移動,甲烷的轉化率不變,故C錯誤;
D、增大水蒸氣濃度,反應速率加快,平衡向逆反應方向移動,甲烷的轉化率增大,故D正確;
故答案為:BD;
(2)平衡常數只受溫度影響,與反應物的濃度無關,提高氫碳比[n(H2O)/n(CO)],K值不變;
令開始H2O和CO的物質的量都是1mol,某一時刻時CO和CO2的濃度比為1:3,設此時參加反應CO為xmol,則(1-x):x=1:3,解得x=0.75,則:
H2O(g)+CO(g)?H2(g)+CO2(g),
開始(mol):1 1 0 0
變化(mol):0.75 0.75 0.75 0.75
某時刻(mol):0.25 0.25 0.75 0.75
故產生濃度商Qc=$\frac{0.75×0.75}{0.25×0.25}$=9<9.94,反應向正反應進行,故v(正)>v(逆),
故答案為:不變;>;
(3)A.固氮指由游離態的氮轉化為化合態的氮,合成氨屬于人工固氮,故A正確;
B.催化劑加快反應速率,不能影響平衡移動,不能提高反應物的利用率,故B錯誤;
C.該反應正反應是放熱反應,高溫不利用氨氣的合成,合成氨反應溫度控制在500℃左右,在該溫度下反應速率較快、催化劑活性較高,故C錯誤;
D.合成氨工業采用循環操作,目的是提高原料的利用率,故D錯誤;
故答案為:A;
(4)根據尿素的化學式CO(NH2)2,C、N原子完全利用最后,由C、N原子守恒可知生產尿素過程中,理論上n(NH3):n(CO2)的最佳配比為2:1;
往往使n(NH3):n(CO2)≥3,這是由于:有利于提高CO2的轉化率,且NH3極易溶于水,便于分離、回收利用;
故答案為:2:1;有利于提高CO2的轉化率,且NH3極易溶于水,便于分離、回收利用;
(5)由CH4(g)+H2O(g)?CO(g)+3H2(g),N2(g)+3H2(g)?2NH3(g),可得CH4(g)~3H2(g)~2NH3(g),設能夠合成氨氣的體積為VL,則:
CH4(g)~3H2(g)~2NH3(g),
1 2
3.0×108L×60% VL
故V=3.0×108L×60%×2=3.6×108L
合成氣的反應中:CH4~~~~~~~~~CO~~~~~~~~~~3H2,
3.0×108L×60% 3.0×108L×60% 3.0×108L×60%×3
分離二氧化碳過程生成的H2體積:CO~~~~~~~~~~H2,
3.0×108L×60% 3.0×108L×60%
所以產生的氫氣的總體積為3.0×108L×60%×3+3.0×108L×60%=12×108L×60%
令產生氨氣的體積為V,則:
3H2~~~~~~~~~2NH3
3 2
12×108L×60% V
故V=12×108L×60%×$\frac{2}{3}$=4.8×108L
故答案為:4.8×108.
點評 考查學生對工藝流程的理解、化學平衡移動及平衡常數與計算、合成氨條件的選擇等,難度中等,關鍵是掌握整個制備流程原理,要求學生要有扎實的基礎知識和靈活應用知識解決問題的能力.(4)中計算為易錯點,容易忽略分離二氧化碳過程生成的H2體積.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 分子式為C3H6有機物最多存在4個C-C單鍵,與C5H12的碳碳單鍵數相同 | |
| B. | 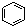 和 和  均是芳香烴, 均是芳香烴, 既是芳香烴又是芳香化合物 既是芳香烴又是芳香化合物 | |
| C. | 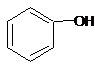 和 和 分子組成相差一個-CH2-,因此是同系物 分子組成相差一個-CH2-,因此是同系物 | |
| D. | 分子式為C2H6O的紅外光譜圖上發現有C-H鍵和C-O鍵的振動吸收,由此推測可能有H-O鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
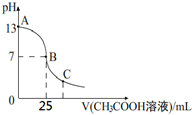 25℃時,向25mL 一定濃度的 NaOH溶液中逐滴加入某濃度的 CH3COOH溶液,溶液pH和加入的醋酸溶液的體積關系曲線如圖所示.下列有關混合溶液說法錯誤的是( )
25℃時,向25mL 一定濃度的 NaOH溶液中逐滴加入某濃度的 CH3COOH溶液,溶液pH和加入的醋酸溶液的體積關系曲線如圖所示.下列有關混合溶液說法錯誤的是( )| A. | A、B間的溶液中可能有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | B點:c(CH3COO-)=c(Na+)>c(OH-)=c(H+) | |
| C. | C點:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | NaOH溶液和醋酸溶液的濃度都恰好為0.1 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向碘化鉀溶液中加入用硫酸酸化的過氧化氫溶液:2I-+H2O2═I2+2OH- | |
| B. | 向碳酸氫銨溶液中加入過量的稀氫氧化鈉溶液:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O | |
| C. | 向Ba(OH)2溶液中加入過量NH4HSO4:Ba2++H++NH4++2OH-+SO 42-═BaSO4↓+H2O+NH3•H2O | |
| D. | Fe2O3溶于過量的氫碘酸中:Fe2O3+6H+═2Fe3++3H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 23g鈉與足量氧氣充分反應,轉移的電子個數為NA | |
| B. | 將1molFeCl3水解制成膠體,所得膠體的微粒數為NA | |
| C. | 1mol Na2O2與水完全反應時轉移電子數為2NA | |
| D. | NA個一氧化碳分子和0.5 mol甲烷的質量比為7:4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | X | Y | Z |
| ① | N2 | Mg | CO2 |
| ② | KOH溶液 | SiO2 | 氫氟酸 |
| ③ | O2 | N2 | H2 |
| ④ | 稀硝酸 | Fe | FeCl3溶液 |
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 42g乙烯和丙烯的混合氣體中碳原子數目一定為3NA. | |
| B. | 用惰性電極電解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液復原,則電解時產生標準狀況下1.12L的氣體 | |
| C. | 配制一定物質的量濃度的NaOH溶液,把NaOH固體于燒杯中充分溶解,并迅速轉移到容量瓶中定容 | |
| D. | 30g的NO與O2充分反應后,生成的氣體分子數為1NA. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
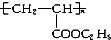 ,下列有關敘述正確的是( )
,下列有關敘述正確的是( )| A. | 其單體是CH2=CH2和HCOOC2H5 | B. | 它是縮聚反應產物 | ||
| C. | 其鏈節是CH3CH2-COOC2H5 | D. | 其單體是CH2=CH-COOC2H5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com