
| 物質 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
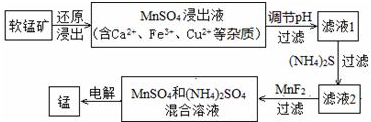
分析 (1)高溫條件下,Al和Mn3O4發生置換反應生成Mn和氧化鋁;
(2)軟錳礦還原浸出得到MnSO4溶液,說明浸取液為稀硫酸,同時溶液中還含有Ca2+、Fe3+、Cu2+等雜質,調節溶液的pH,Fe(OH)3pKap為37.4與其它離子相比最大,調節pH可以將 Fe(OH)3沉淀下來,向濾液中加入硫化銨,CuSpKap為35.2,可以將銅離子形成硫化物沉淀下來,再加入MnF2,形成CaF2沉淀,除去Ca2+,最后對得到的含有錳離子的鹽電解,可以得到金屬Mn;
①該反應中Mn元素化合價由+4價變為+2價、C元素化合價由0價變為+4價,失電子化合價升高的反應物是還原劑;增大反應物濃度、升高溫度、增大反應物接觸面積都能增大反應速率;
②軟錳礦還原浸出的反應為:12MnO2+C6H12O6+12H2SO4=12MnSO4+6CO2↑+18H2O,溶液呈強酸性,還原浸出液中含有Mn2+、Ca2+、Fe3+、Cu2+,此時未形成沉淀,Kp為電離平衡常數,pKp=-1gKp,pKp越大,沉淀溶解平衡常數越小,濾液1為形成Fe(OH)3沉淀,pKp=-1gKp=37.4,Kp=10-37.4,Kp=c(Fe3+)×c3(OH-)=10-37.4,c(OH-)≈10-10,c(H+)=1×10-4mol/L,pH=4,據此判斷pH大小;
③加入MnF2的目的除去形成CaF2沉淀,除去Ca2+;
(3)錳離子和碳酸氫根離子發生雙水解反應生成碳酸錳沉淀;由MnCO3(s)+2OH-(aq)?Mn(OH)2(s)+CO32-(aq)可知,K=$\frac{c(C{{O}_{3}}^{2-})}{{c}^{2}(O{H}^{-})}$=$\frac{\frac{{K}_{sp}(MnC{O}_{3})}{c(M{n}^{2+})}}{\frac{{K}_{sp}[Mn(OH)_{2}]}{c(M{n}^{2+})}}$.
解答 解:(1)高溫條件下,Al和Mn3O4發生置換反應生成Mn和氧化鋁,反應方程式為8Al+3Mn3O4$\frac{\underline{\;高溫\;}}{\;}$4Al2O3+9Mn,故答案為:8Al+3Mn3O4$\frac{\underline{\;高溫\;}}{\;}$4Al2O3+9Mn;
(2)軟錳礦還原浸出得到硫酸錳溶液,說明浸取液為稀硫酸,同時溶液中還含有Ca2+、Fe3+、Cu2+等雜質,調節溶液的pH,Fe(OH)3pKap為37.4與其它離子相比最大,調節pH可以將 Fe(OH)3沉淀下來,向濾液中加入硫化銨,CuSpKap為35.2,可以將銅離子形成硫化物沉淀下來,再加入MnF2,形成CaF2沉淀,除去Ca2+,最后對得到的含有錳離子的鹽電解,可以得到金屬錳,
①軟錳礦還原浸出的反應為:12MnO2+C6H12O6+12H2SO4═12MnSO4+6CO2↑+18H2O,該反應中,Mn元素化合價由+4價變為+2價、C元素化合價由0價變為+4價,失電子化合價升高的反應物是還原劑,所以C6H12O6為還原劑;
反應物接觸面積越大、溫度越高反應速率越快,所以能提高還原浸出速率的措施:升高反應溫度或將軟錳礦研細等,
故答案為:C6H12O6;升高反應溫度或將軟錳礦研細等;
②軟錳礦還原浸出的反應為:12MnO2+C6H12O6+12H2SO4=12MnSO4+6CO2↑+18H2O,溶液呈強酸性,還原浸出液中含有Mn2+、Ca2+、Fe3+、Cu2+,此時未形成沉淀,Kp為電離平衡常數,pKp=-1gKp,pKp越大,沉淀溶解平衡常數越小,濾液1為形成Fe(OH)3沉淀,pKp=-1gKp=37.4,Kp=10-37.4,Kp=c(Fe3+)×c3(OH-)=10-37.4,c(OH-)≈10-10,c(H+)=1×10-4mol/L,pH=4,所以濾液1的pH大于MnSO4浸出液的pH=4才能形成氫氧化鐵沉淀,
故答案為:>;
③CaF2難溶于水,濾液2為Mn2+、Ca2+、NH4+、SO42-,加入MnF2的目的除去形成CaF2沉淀,除去Ca2+,故答案為:Ca2+;
(3)錳離子和碳酸氫根離子反應生成碳酸錳沉淀、水和二氧化碳氣體,離子方程式為Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;由MnCO3(s)+2OH-(aq)?Mn(OH)2(s)+CO32-(aq)可知K=$\frac{c(C{{O}_{3}}^{2-})}{{c}^{2}(O{H}^{-})}$=$\frac{\frac{{K}_{sp}(MnC{O}_{3})}{c(M{n}^{2+})}}{\frac{{K}_{sp}[Mn(OH)_{2}]}{c(M{n}^{2+})}}$=$\frac{1{0}^{-10.7}}{1{0}^{-12.7}}$=100,
故答案為:Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;100.
點評 本題考查物質分離和提純和制備,為高頻考點,涉及難溶物的溶解平衡、離子方程式書寫、氧化還原反應等知識點,側重考查基本理論,難點是難溶物溶解平衡計算,題目難度中等,熟悉流程圖中發生的反應及基本操作方法.


 一諾書業暑假作業快樂假期云南美術出版社系列答案
一諾書業暑假作業快樂假期云南美術出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | “霧霾天氣”、“溫室效應”、“光化學煙霧”的形成都與氮的氧化物無關 | |
| B. | 乙醇溶液、臭氧、雙氧水、高錳酸鉀溶液均可用于消毒殺菌,且原理不同 | |
| C. | 生石灰、鐵粉、硅膠是食品包裝中常用的干燥劑 | |
| D. | 純堿是焙制糕點所用的發酵粉的主要成分之一,也可用純堿除去物品表面的油污 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
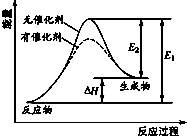
| A. | 該反應為放熱反應 | |
| B. | 催化劑能降低該反應的焓變 | |
| C. | 催化劑能降低E2的值 | |
| D. | 逆反應的活化能大于正反應的活化能 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 125 mL | B. | 275 mL | C. | 325 mL | D. | 450 mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 萃取溴水中的溴,將四氯化碳和溴水混合后,振蕩并打開分液漏斗瓶塞,使漏斗內氣體放出 | |
| B. | 在蔗糖中加入濃硫酸時,蔗糖變黑,證明濃硫酸具有脫水性 | |
| C. | 向Ba(NO3)2溶液中通入SO2氣體,產生白色沉淀,可推測SO2與可溶性鋇鹽均能反應產生白色沉淀 | |
| D. | 若要檢驗銅和濃硫酸反應后產物硫酸銅,可向反應后的試管中加入少量水,觀察溶液是否變藍,若變藍則證明有硫酸銅生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
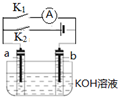
| A. | 斷開K2,閉合K1一段時間,溶液的pH要變大 | |
| B. | 斷開K1,閉合K2時,b極上的電極反應式為 2H++2e-═H2↑ | |
| C. | 斷開K1,閉合K2時,OH-向b極移動 | |
| D. | 斷開K2,閉合K1時,a極上的電極反應式為:4OH--4e-═O2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 22 | B. | 24 | C. | 20 | D. | 25 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
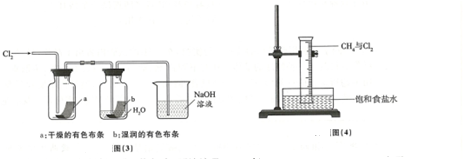
| 實驗現象 | 原因 |
| 溶液從初的紫色逐漸變為紅色 | 氯氣與水反應生成的H+使石蕊試液變色 |
| 隨后溶液逐漸變為無色 | 氯氣與水反應生成的HClO將石蕊氧化為無色物質 |
| 然后溶液從無色逐漸變為黃綠色 | 繼續通入的氯氣溶于水使溶液呈黃綠色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Ca(OH)═Ca2++2OH- | B. | KNO3═K++NO3- | C. | NH4Cl═4NH++Cl- | D. | H2SO4═2H++SO42- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com