
工業生產硫酸過程中,SO2在接觸室中被催化氧化為SO3,已知該反應為放熱反應。現將2 mol SO2、1 mol O2充入一密閉容器充分反應后,放出熱量98.3 kJ,此時測得SO2的轉化率為50%。下列熱化學方程式正確的是( )。
A.2SO3(g) 2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1
2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1
B.2SO2(g)+O2(g) SO3(g) ΔH=-98.3 kJ·mol-1
SO3(g) ΔH=-98.3 kJ·mol-1
C.SO2(g)+ O2(g)
O2(g) SO3(g) ΔH=+98.3 kJ·mol-1
SO3(g) ΔH=+98.3 kJ·mol-1
D.SO2(g)+ O2(g)
O2(g) SO3(g) ΔH=-196.6 kJ·mol-1
SO3(g) ΔH=-196.6 kJ·mol-1
科目:高中化學 來源:2013-2014學年高考化學二輪復習四川配套訓練 第11講有機化學基礎練習卷(解析版) 題型:填空題
某課題組以苯為主要原料,采用以下路線合成利膽藥——柳胺酚
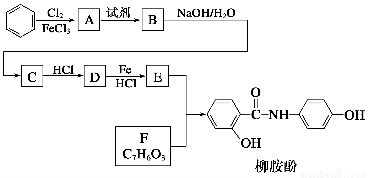
已知:
回答下列問題:
(1)對于柳胺酚,下列說法正確的是________。
A.1 mol柳胺酚最多可以和2 mol NaOH反應
B.不發生硝化反應
C.可發生水解反應
D.可與溴發生取代反應
(2)寫出A→B反應所需的試劑________。
(3)寫出B→C的化學方程式________________________________。
(4)寫出化合物F的結構簡式__________。
(5)寫出同時符合下列條件的F的同分異構體的結構簡式________________
________________________________________(寫出3種)。
①屬酚類化合物,且苯環上有三種不同化學環境的氫原子。
②能發生銀鏡反應。
(6)以苯和乙烯為原料可合成聚苯乙烯,請設計合成路線(無機試劑及溶劑任選)
注:合成路線的書寫格式參照如下示例流程圖:
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習 專題7電解質溶液練習卷(解析版) 題型:填空題
亞磷酸(H3PO3)是二元酸,與足量NaOH溶液反應生成Na2HPO3。
(1)PCl3水解可制取亞磷酸:PCl3+3H2O===H3PO3+________。
(2)H3PO3溶液中存在電離平衡:H3PO3 H++H2PO3—。
H++H2PO3—。
①某溫度下,0.10 mol·L-1的H3PO3溶液pH=1.6,即溶液中c(H+)=2.5×
10-2 mol·L-1。求該溫度下上述電離平衡的平衡常數K,寫出計算過程。(H3PO3的第二步電離忽略不計,結果保留兩位有效數字)
②根據H3PO3的性質可推測Na2HPO3稀溶液的pH________7(填“>”“=”或“<”)。
(3)亞磷酸具有強還原性,可使碘水褪色。該反應的化學方程式為________。
(4)電解Na2HPO3溶液也可得到亞磷酸,裝置示意圖如下:

①陰極的電極反應式為________________________;
②產品室中反應的離子方程式為_____________________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習 專題6化學反應速率和化學平衡練習卷(解析版) 題型:選擇題
在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3— (aq)。測得不同溫度下該反應的平衡常數K如表所示:
I3— (aq)。測得不同溫度下該反應的平衡常數K如表所示:
t/℃ | 5 | 15 | 25 | 35 | 50 |
K | 1 100 | 841 | 689 | 533 | 409 |
下列說法正確的是 ( )。
A.反應I2(aq)+I-(aq) I3— (aq)的ΔH>0
I3— (aq)的ΔH>0
B.其他條件不變,升高溫度,溶液中c(I3—)減小
C.該反應的平衡常數表達式為K=
D.25 ℃時,向溶液中加入少量KI固體,平衡常數K小于689
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習 專題5化學反應與能量變化練習卷(解析版) 題型:填空題
(1)(廣東)由磷灰石[主要成分Ca5(PO4)3F]在高溫下制備黃磷(P4)的熱化學方程式為:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)===3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反應中,副產物礦渣可用來________。
②已知相同條件下:
4Ca5(PO4)3F(s)+3SiO2(s)===6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)===P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)===CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=____________。
(2)(江蘇)用H2O2和H2SO4的混合溶液可溶出印刷電路板金屬粉末中的銅。已知:
①Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1=+64.39 kJ·mol-1
②2H2O2(l)===2H2O(l)+O2(g) ΔH2=-196.46 kJ·mol-1
③H2(g)+ O2(g)===H2O(l) ΔH3=-285.84 kJ·mol-1
O2(g)===H2O(l) ΔH3=-285.84 kJ·mol-1
在H2SO4溶液中,Cu與H2O2反應生成Cu2+和H2O的熱化學方程式為______。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習 專題4物質結構與元素周期律練習卷(解析版) 題型:填空題
X、Y、Z、L、M五種元素的原子序數依次增大。X、Y、Z、L是組成蛋白質的基礎元素,M是地殼中含量最高的金屬元素。
回答下列問題:
(1)L的元素符號為________;M在元素周期表中的位置為________;五種元素的原子半徑從大到小的順序是________(用元素符號表示)。
(2)Z、X兩元素按原子數目比1∶3和2∶4構成分子A和B,A的電子式為________,B的結構式為________。
(3)硒(Se)是人體必需的微量元素,與L同一主族,Se原子比L原子多兩個電子層,則Se的原子序數為________,其最高價氧化物對應的水化物化學式為________,該族二~五周期元素單質分別與H2反應生成1 mol氣態氫化物的反應熱如下,表示生成1 mol硒化氫反應熱的是________(填字母代號)。
a.+99.7 kJ·mol-1 b.+29.7 kJ·mol-1c.-20.6 kJ·mol-1 d.-241.8 kJ·mol-1
(4)用M單質作陽極,石墨作陰極,NaHCO3溶液作電解液進行電解,生成難溶物R,R受熱分解生成化合物Q。寫出陽極生成R的電極反應式:____________________________________;由R生成Q的化學方程式為________________________________________________________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習 專題4物質結構與元素周期律練習卷(解析版) 題型:選擇題
下圖是部分短周期元素原子(用字母表示)最外層電子數與原子序數的關系圖。下列說法正確的是(雙選)( )。

A.X和R在同一周期
B.原子半徑:W>R>X
C.氣態氫化物的穩定性:Y>X
D.X、Z形成的化合物中可能含有共價鍵
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習 專題2常用化學計量--物質的量練習卷(解析版) 題型:選擇題
下圖是NaCl、MgSO4的溶解度曲線。下列說法正確的是( )。
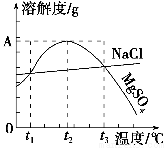
A.只有在t1℃時,NaCl和MgSO4的溶解度才相等
B.t1℃~t2℃,MgSO4的溶解度隨溫度升高而減小
C.在t2℃時,MgSO4飽和溶液的溶質質量分數最大
D.把MgSO4飽和溶液的溫度從t3℃降至t2℃時,溶液的物質的量濃度減小
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習 專題13化學實驗綜合應用練習卷(解析版) 題型:實驗題
某化學小組在學習元素周期律知識后,對教材中Cl2將Fe2+氧化成Fe3+的實驗進一步思考,并提出問題:Cl2能將Fe2+氧化成Fe3+,那么Br2和I2能否將Fe2+氧化成Fe3+?
環節一:理論推測。
部分同學認為Br2和I2都能將Fe2+氧化成Fe3+,依據是
____________________________________________。
部分同學認為Br2和I2都不能將Fe2+氧化成Fe3+。還有同學認為Br2能將
Fe2+氧化成Fe3+,而I2不能,依據是同一主族從上到下鹵素單質的氧化性逐漸減弱。
環節二:設計實驗進行驗證。
向大試管中加入適量鐵粉,加入10 mL稀鹽酸,振蕩試管,充分反應后,鐵粉有剩余,取上層清液進行下列實驗。
實驗1:
試管 | 操作 | 現象 |
① | 先向試管中加入2 mL新制的FeCl2溶液,再向試管中滴加少量紅棕色的溴水,振蕩試管 | 溶液為黃色 |
② | 先向試管中加入2 mL新制的FeCl2溶液,再向試管中滴加少量棕黃色的碘水,振蕩試管 | 溶液為黃色 |
環節三:實驗現象的分析與解釋。
(1)甲同學認為試管①中的現象說明溴水能將Fe2+氧化,反應的離子方程式為______________________________________________________。
乙同學認為應該補做實驗,才能得出甲同學的結論。請你幫助乙同學完成實驗:
實驗2:
操作 | 現象 |
|
|
(2)該小組同學對試管②中所得的溶液呈黃色的原因展開討論,并提出了兩種假設:
假設1:碘水與FeCl2溶液不反應,黃色是碘水稀釋后的顏色。
假設2.________________。
實驗3:進行實驗以判斷假設是否成立。
操作 | 現象 |
向試管②所得的溶液中繼續加入0.5 mL CCl4,充分振蕩,靜置一段時間。取出上層溶液,滴加KSCN溶液 | 靜置后,上層溶液幾乎無色,下層溶液為紫色;取上層溶液滴加KSCN溶液后,溶液呈淺紅色 |
丙同學認為實驗3的現象可以說明假設2成立,丁同學認為不嚴謹,于是設計了實驗4繼續探究。
實驗4:
操作 | 現象 |
向另一支試管中加入2 mL新制的FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振蕩,靜置一段時間。取出下層溶液,滴加KSCN溶液 | 靜置后,上層溶液為紫色,下層溶液幾乎無色;取下層溶液,向其中滴加KSCN溶液后,溶液沒有呈淺紅色 |
你認為實驗4中加入乙酸乙酯的主要目的是_____________________。
丁同學根據實驗4的現象得出結論:在本次實驗條件下,碘水與FeCl2溶液反應的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐漸減弱,從原子結構角度解釋原因:_____________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com