
分析 (1)根據氯氣具有氧化性,能氧化溴離子生成單質溴;
(2)濃縮海水經氧化后通入熱空氣將 Br2吹出,將吹出的 Br2用純堿溶液吸收,目的是低濃度的Br2溶液在提取時消耗過多的原料和能源,根據反應物、生成物,利用化合價升降總數相等和質量守恒來配平;
(3)根據Br-和BrO3-在酸性條件下發生歸中反應生成Br2;
(4)根據各步反應,可確定如下關系:CaCO3~CO2~Br2,根據CaCO3的質量求出Br2的質量,根據C=$\frac{m}{V}$來計算.
解答 解:(1)因氯氣具有氧化性,能氧化溴離子生成單質溴:Cl2+2Br-═Br2+2Cl-;
故答案為:Cl2+2Br-═Br2+2Cl-;
(2)濃縮海水經氧化后通入熱空氣將 Br2吹出,將吹出的 Br2用純堿溶液吸收,目的是低濃度的Br2溶液在提取時消耗過多的原料和能源,轉化為HBr后易被氧化劑氯氣氧化為溴單質,用于富集溴元素,生成一個NaBr化合價降低1,生成一個NaBrO3化合價升高5,根據化合價升降總數相等和質量守恒來配平得:
3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑,
故答案為:富集溴元素:3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑,
(3)因Br-和BrO3-在酸性條件下發生歸中反應生成Br2:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O,離子方程式為:5Br-+BrO3-+6H+═3Br2+3H2O
故答案為:5Br-+BrO3-+6H+═3Br2+3H2O;
(4)根據各步反應,可確定如下關系:Br2~CO2~CaCO3,根據CaCO3的質量
可求出原24L海水中Br2的質量為$\frac{160g/mol×1g}{100g/mol}$=1.6 g,
則海水中溴的濃度為$\frac{1.6g}{24L}$=0.067 g/L,
故答案為:0.067.
點評 本題結合海水提取溴的過程,考查了氧化還原反應、化學計算、方程式的書寫,題目難度中等,在配平時抓住化合價升降總數相等.


 53隨堂測系列答案
53隨堂測系列答案科目:高中化學 來源: 題型:選擇題
| A. | CH3-CH═CH-CH3 二丁烯 | B. | 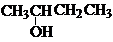 2-羥基丁烷 2-羥基丁烷 | ||
| C. | CH3OOCC2H5 乙酸乙酯 | D. | CH3CH(CH3)CH2COOH 3-甲基丁酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③⑤ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碘酒是指單質碘的乙醇溶液 | B. | 84 消毒液的有效成分是 NaClO | ||
| C. | 濃硫酸可刻蝕石英制藝術品 | D. | 裝飾材料釋放的甲醛會造成污染 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
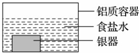 銀制器皿表面日久因生成 Ag2S 而變黑,可進行如下處理:將表面發黑的銀器浸入盛有食鹽水的鋁質容器中(如圖),一段時間后黑色褪去.有關說法正確的是
銀制器皿表面日久因生成 Ag2S 而變黑,可進行如下處理:將表面發黑的銀器浸入盛有食鹽水的鋁質容器中(如圖),一段時間后黑色褪去.有關說法正確的是| A. | 該處理過程中電能轉化為化學能 | B. | 銀器為正極,Ag2S 還原為單質銀 | ||
| C. | 鋁質容器為陽極,其質量變輕 | D. | Ag2S 溶解于食鹽水生成了 AgCl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | b 電極上的主要反應是:SO23--2e-+H2O═SO2 4-+2H+ | |
| B. | 若 D 是混合氣體,則可能含有 SO2、O2等成分 | |
| C. | a 電極發生還原反應,當有 1 mol Na+通過陽離子交換膜時,a 極生成 11.2 L 氣體 | |
| D. | A 溶液是稀 NaOH 溶液,作用是增強溶液的導電性,C 是較濃的硫酸溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應速率用于衡量化學反應進行的快慢 | |
| B. | 決定反應速率的主要因素是反應物的性質 | |
| C. | 增大反應物的濃度、提高反應溫度都能增大反應速率 | |
| D. | 可逆反應達到化學平衡狀態時,正、逆反應的速率都為0 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com