

分析 (1)由圖可知B2O3與CaF2和H2SO4反應即生成BF3,同時還應該產生硫酸鈣和水,結合原子個數守恒寫出方程式;
(2)基態B原子核外有5個電子,根據核外電子排布規律書寫電子排布式;依據同周期從左到右電負性依次增強,判斷電負性強弱;B第ⅢA族元素,為+3價;
(3)價層電子對互斥理論認為:分子的立體構型是“價層電子對”相互排斥的結果,先判斷價層電子對數,再確定構型和雜化方式;價層電子對互斥理論判斷其σ電子對和孤電子對數目.
解答 解:(1)由工藝流程可知,B2O3與NH3反應生成BN,根據原子守恒可知,還有水生成,反應方程式為:B2O3+3CaF2+3H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2BF3↑+3CaSO4+3H2O;B2O3+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$2BN+3H2O;
故答案為:B2O3+3CaF2+3H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2BF3↑+3CaSO4+3H2O;B2O3+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$2BN+3H2O;
(2)硼原子核外電子數目為5,原子的電子排布式為1s22s22p1;同周期從左到右電負性依次增強,所以電負性N>B;B第ⅢA族元素,為+3價;
故答案為:1s22s22p1;N;+3;
(3)BF3分子的中心原子B原子上含有3個σ 鍵,中心原子上的孤電子對數=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(0-3×1)=0,所以BF3分子的VSEPR模型是平面三角型,中心原子上沒有孤對電子,所以其空間構型就是平面三角形,鍵角是120°,BF3分子的中心原子B原子的價層電子對數為;3,屬于sp2雜化;BF3和過量NaF作用可生成NaBF4,BF4-中B原子的價層電子對=4+$\frac{1}{2}$=4,該離子中不含孤電子對,為正四面體結構.
故答案為:120°;sp2;正四面體.
點評 本題考查結構性質位置關系、核外電子排布規律、雜化軌道、電負性等,題難度中等,注意對相關知識的應用.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
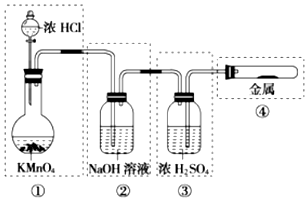
| A. | ①和②處 | B. | ②處 | C. | ②和③處 | D. | ②③④處 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氣體A為SO2和H2的混合物 | B. | 氣體A中SO2和H2的體積比為4:1 | ||
| C. | 反應中共消耗Zn 97.5g | D. | 反應中共轉移3mol電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 為測定含有Na2O雜質的Na2O2樣品的純度,甲同學設計以下的方案.用如圖所示裝置,通過測定Na2O2與C02反應生成02的體積來測定樣品的純度.
為測定含有Na2O雜質的Na2O2樣品的純度,甲同學設計以下的方案.用如圖所示裝置,通過測定Na2O2與C02反應生成02的體積來測定樣品的純度.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X3Y2 | B. | X2Y | C. | Y3X2 | D. | Y2X3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫時,某溶液中由水電離出來的c(H+)和c(OH-)的乘積為l×10-24,該溶液中一定可以大量存在K+、Na+、AlO2-、SO42- | |
| B. | 1 mol Na2O和Na2O2混合物中含有的陰、陽離子總數是3NA | |
| C. | 在中和滴定實驗中,既可用標準溶液滴定待測液,也可用待測液滴定標準溶液 | |
| D. | 某一反應體系中的物質有:HC1、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知As是產物之一,則該反應配平后H2O的化學計量數為6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
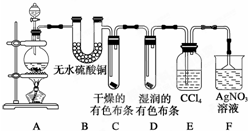 某校化學實驗興趣小組為了探究在實驗室制備Cl2的過程中有水蒸氣和HCl揮發出來,同時探究氯氣的漂白原理,甲同學設計了如圖所示的實驗裝置(支撐用的鐵架臺省略),按要求回答問題.
某校化學實驗興趣小組為了探究在實驗室制備Cl2的過程中有水蒸氣和HCl揮發出來,同時探究氯氣的漂白原理,甲同學設計了如圖所示的實驗裝置(支撐用的鐵架臺省略),按要求回答問題.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com