
| A. | 原HA溶液中,c(H+)=c(A-) | |
| B. | 當恰好完全中和時,溶液呈中性 | |
| C. | 當NaOH溶液過量時,可能出現:c(A-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 當滴入少量的NaOH,促進了HA的電離,溶液的pH升高 |
分析 A.根據電荷守恒分析;
B.0.01mol•L-1HA溶液的pH=3,說明HA為弱酸,酸堿恰好反應生成強堿弱酸鹽;
C.根據電荷守恒分析;
D.氫氧化鈉會消耗氫離子,氫離子濃度減小,HA的電離平衡正移.
解答 解:A.原HA溶液中,存在電荷守恒:c(H+)=c(A-)+c(OH-),所以c(H+)<c(A-),故A錯誤;
B.0.01mol•L-1HA溶液的pH=3,說明HA部分電離為弱酸,酸堿恰好反應生成強堿弱酸鹽,所以NaA會發生水解顯堿性,故B錯誤;
C.溶液中存在電荷守恒:c(A-)+c(OH-)=c(Na+)+c(H+),當c(A-)>c(Na+)時,則c(OH-)<c(H+),故C錯誤;
D.當滴入少量的NaOH,氫氧化鈉會消耗氫離子,氫離子濃度減小,HA的電離平衡正移,促進了HA的電離,氫離子濃度減小,所以溶液的pH升高,故D正確.
故選D.
點評 本題考查酸堿混合的定性判斷及溶液pH的計算,題目難度中等,涉及離子濃度大小比較、電荷守恒等知識,解題時注意電荷守恒及物料守恒的應用,明確溶液酸堿性與溶液pH的關系為解答關鍵.


科目:高中化學 來源: 題型:多選題
| A. | c(H+)>c(OH-) | B. | c(H+)<c(OH-) | ||
| C. | c(CH3COOH)>c( CH3COO-) | D. | c(CH3COOH)+c(CH3COO- )=0.2mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 放一大盆水于室內 | B. | 放一大盆苯于室內加以溶解吸收 | ||
| C. | 灑一些酸性KMnO4溶液于地面 | D. | 打開窗戶,長時間通風 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
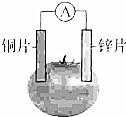 甲乙兩位同學一起做水果電池的實驗,測得數據如下:
甲乙兩位同學一起做水果電池的實驗,測得數據如下:| 試驗編號 | 電極材料 | 水果品種 | 電極間距/cm | 電壓/mV | |
| 1 | 鋅 | 銅 | 菠蘿 | 3 | 900 |
| 2 | 鋅 | 銅 | 蘋果 | 3 | 650 |
| 3 | 鋅 | 銅 | 柑桔 | 3 | 850 |
| 4 | 鋅 | 銅 | 西紅柿 | 3 | 750 |
| 5 | 鋅 | 鋁 | 菠蘿 | 3 | 650 |
| 6 | 鋅 | 鋁 | 蘋果 | 3 | 450 |
| A. | ③ | B. | ① | C. | ①②③ | D. | ②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
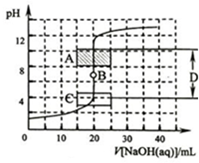 酸堿中和滴定是利用中和反應,用已知濃度的酸(或堿)來測定未知濃度的堿(或酸)的試驗方法.例如用一定濃度的氫氧化鈉溶液滴定一定濃度的鹽酸,其間溶液的pH變化是判斷滴定終點的依據.
酸堿中和滴定是利用中和反應,用已知濃度的酸(或堿)來測定未知濃度的堿(或酸)的試驗方法.例如用一定濃度的氫氧化鈉溶液滴定一定濃度的鹽酸,其間溶液的pH變化是判斷滴定終點的依據.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
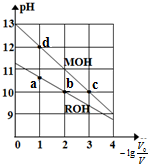 常溫下,向體積均為V0、濃度均為0.10mol•L-1的MOH和ROH溶液中分別加水稀釋至體積為V,溶液pH隨-lg$\frac{{v}_{0}}{v}$的變化如圖所示,下列敘述正確的是( )
常溫下,向體積均為V0、濃度均為0.10mol•L-1的MOH和ROH溶液中分別加水稀釋至體積為V,溶液pH隨-lg$\frac{{v}_{0}}{v}$的變化如圖所示,下列敘述正確的是( )| A. | b、c兩點的溶液中:c(R+)>c(M+) | |
| B. | MOH的電離程度:c點小于d點 | |
| C. | 溶液中水的電離程度:b>c>a>d | |
| D. | 當-lg$\frac{{v}_{0}}{v}$=2時,若兩溶液同時升高溫度,則$\frac{c({R}^{+})}{c({M}^{+})}$增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 過量石灰水與碳酸氫鈣反應:Ca2++2HCO3-+2OH-═=CaCO3↓+CO32-+2H2O | |
| B. | FeSO4酸性溶液暴露在空氣中:4Fe2++O2+4H+═4Fe3++2H2O | |
| C. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| D. | 酸性溶液中KlO3與KI反應生成I2:IO3-+I-+6H+═I2+3H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com