
 .其基態原子有26種能量不同的電子;
.其基態原子有26種能量不同的電子;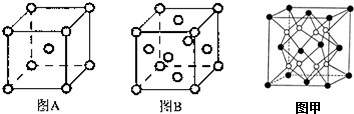
分析 X、Y、Z、M、R、W均為周期表中前四周期的元素,X的基態原子外圍電子排布式為3s2,則X為第三周期ⅡA族元素,為Mg元素;
Y基態原子的L電子層的p能級上有一個空軌道,原子核外電子排布為1s22s22p2,則B為C元素;
Z元素的基態原子最外層有3個未成對電子,次外層有2個電子,則Z處于第二周期,電子排布式為:1s22s22p3,為N元素;
M的基態原子的2p軌道上有1個電子的自旋方向與其它電子的自旋方向相反,原子核外電子排布為1s22s22p4,則M為O元素;
R是海水中除氫、氧元素外含量最多的元素,則R為Cl元素;
W為過渡元素,它的基態原子外圍電子排布成對電子數和未成對電子數相同且為最外層電子數的兩倍,其外圍電子排布式為:3d64s2,核外電子排布為:1s22s22p63s23p63d64s2,故W為Fe元素,據此進行解答.
解答 解:X、Y、Z、M、R、W均為周期表中前四周期的元素,X的基態原子外圍電子排布式為3s2,則X為第三周期ⅡA族元素,為Mg元素;Y基態原子的L電子層的p能級上有一個空軌道,原子核外電子排布為1s22s22p2,則B為C元素;Z元素的基態原子最外層有3個未成對電子,次外層有2個電子,則Z處于第二周期,電子排布式為:1s22s22p3,為N元素;M的基態原子的2p軌道上有1個電子的自旋方向與其它電子的自旋方向相反,原子核外電子排布為1s22s22p4,則M為O元素;R是海水中除氫、氧元素外含量最多的元素,則R為Cl元素;W為過渡元素,它的基態原子外圍電子排布成對電子數和未成對電子數相同且為最外層電子數的兩倍,其外圍電子排布式為:3d64s2,核外電子排布為:1s22s22p63s23p63d64s2,故W為Fe元素,
(1)W為Fe元素,E為26號元素,其核外電子總數為26,核外電子排布為:1s22s22p63s23p63d64s2,其基態原子的外圍電子排布圖為: ;鐵的基態原子有26種能量不同的電子,
;鐵的基態原子有26種能量不同的電子,
故答案為: ;26;
;26;
(2)R為Cl元素,Cl的氫化物為氯化氫,其上一周期同族元素氫化物為HF,由于氟化氫分子中存在氫鍵,所以氟化氫的沸點高于氯化氫,
故答案為:HF分子中存在氫鍵;
(3)ZM3-為NO3-,NO3-中N原子的價層電子對數為:$\frac{5+1}{2}$=3,沒有孤電子對,所以NO3-的空間構型為平面三角形,N原子采用sp2雜質,
故答案為:平面三角形;sp2;
(4)W與YM易形成配合物W(YM)5為Fe(CO)5,Fe與CO易形成配合物Fe(CO)5化合價的代數和為0,CO的化合價的代數和為0,則Fe的化合價為0;
根據等電子體的定義,CO的等電子體必須是雙原子分子或離子,且電子總數相等,所以與CO分子互為等電子體的離子的化學式為CN-,
故答案為:0;CN-;
(5)A中原子占據體心和頂點,為體心立方結構,原子數為1+8×$\frac{1}{8}$=2,B中占據頂點和面心,原子數為6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,所以體心立方晶胞和面心立方晶胞中實際含有的Fe原子個數之比1:2;A、B晶胞的棱長分別為a cm和b cm,體積分別為a3cm3、b3cm3,晶胞的密度等于晶胞中鐵原子的質量與體積的比,為$\frac{2m}{{a}^{3}}$:$\frac{4m}{{b}^{3}}$=b3:2a3,
故答案為:面心立方;1:2;b3:2a3;
(6)Fe位于面心和頂點,數目為:6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,Mg原子位于體心,數目為8,化學式為:FeMg2或Mg2Fe,
故答案為:FeMg2或Mg2Fe.
點評 本題考查了位置、結構與性質關系的綜合應用、晶胞的計算等知識,題目難度中等,推斷各元素為解答關鍵,注意掌握原子結構與元素周期律、元素周期律的關系,(5)(6)為難點,需要明確均攤法在晶胞計算中的應用.


科目:高中化學 來源: 題型:解答題
| 化學鍵 | H-H | H-F | H-Cl | H-Br |
| 鍵能/kJ/mol | 436 | 565 | 431 | 368 |

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 一名同學把4.48L(一折算成標準狀況下)某有機物蒸汽在O2中充分燃燒,然后讓產物依次通過裝有無水CuSO4的干燥管、盛有濃硫酸的洗氣瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的燒杯,如圖所示:
一名同學把4.48L(一折算成標準狀況下)某有機物蒸汽在O2中充分燃燒,然后讓產物依次通過裝有無水CuSO4的干燥管、盛有濃硫酸的洗氣瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的燒杯,如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2mol | B. | 2.5 mol | C. | 5 mol | D. | 6 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.4mol/L | B. | 1.4mol/L | C. | 1.2mol/L | D. | 0.7mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在AgCl的沉淀溶解平衡體系中,加入蒸餾水,Ksp(AgCl)增大 | |
| B. | 向0.1mol•L-1Na2CO3溶液中加入少量NaOH固體,c(CO32-)與c(Na+)的增大 | |
| C. | NaOH和CH3COONa的混合溶液中,c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| D. | 常溫下,$\frac{{K}_{W}}{c{(H}^{+})}$=0.1mol•L-1 的溶液中,Na+、K+、CO32-、NO3-、離子可大量共存 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 元素代號 | X | Y | Z | L | M | Q |
| 原子半徑/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.112 | 0.074 |
| 主要化合價 | +2 | +3 | +6、-2 | +7、-1 | +2 | -2 |
| A. | 等物質的量的X、Y的單質與足量鹽酸反應,生成H2一樣多 | |
| B. | Y與Q形成的化合物不可能跟氫氧化鈉溶液反應 | |
| C. | Z的氫化物的穩定性強于L的氫化物的穩定性 | |
| D. | 與稀鹽酸反應的劇烈程度:M單質<X單質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子化合物中一定含有金屬元素 | |
| B. | 金屬元素不可能存在于陰離子中 | |
| C. | 含有非極性鍵的化合物不一定是共價化合物 | |
| D. | 由兩種元素構成的共價化合物分子中的化學鍵都是極性鍵 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com