
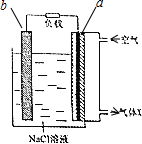
 鎂-空氣電池的工作原理如圖所示.下列說法不正確的是( )
鎂-空氣電池的工作原理如圖所示.下列說法不正確的是( )| A. | 工作一段時間后,c(Na+)變大 | B. | 氣體X中N2的百分量與空氣相同 | ||
| C. | 電池工作時,OH-向a極移動 | D. | 電池總反應為2Mg+O2+2H2O═2Mg(OH)2 |
分析 鎂-空氣電池中,負極金屬Mg失去電子生成Mg2+,正極氧氣得到電子生成OH-,電池總反應為:2Mg+O2+2H2O═2Mg(OH)2;根據反應方程式可知,工作一段時間后,水的量減小,則c(Na+)變大;空氣中氧氣被消耗,則氣體X中N2的百分量大于空氣;然后結合電解質溶液電流從負極流向正極分析氫氧根離子的移動方向.
解答 解:鎂-空氣電池中,負極金屬Mg失去電子生成Mg2+,正極氧氣得到電子生成OH-,電池總反應為:2Mg+O2+2H2O═2Mg(OH)2,
A.根據反應方程式可知,工作一段時間后,水的量減小,則c(Na+)變大,故A正確;
B.原電池工作時消耗空氣中的氧氣,則氣體X中N2的百分量大于空氣,故B錯誤;
C.電解質溶液中,電流從負極流向正極,則氫氧根離子向a極移動,故C正確;
D.根據分析可知,電池總反應為:2Mg+O2+2H2O═2Mg(OH)2,故D正確;
故選B.
點評 本題考查原電池工作原理,題目難度中等,明確電極上得失電子及反應是解本題關鍵,注意掌握原電池兩極及總反應式的書寫方法,試題培養了學生的分析能力及靈活應用能力.


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
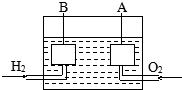 宇宙飛船上使用的氫氧燃料電池是一種新型化學電池,其構造如圖所示,A、B是多孔性炭制成的兩個電極,通入的氣體由孔隙中逸出,并在電極表面放電.
宇宙飛船上使用的氫氧燃料電池是一種新型化學電池,其構造如圖所示,A、B是多孔性炭制成的兩個電極,通入的氣體由孔隙中逸出,并在電極表面放電.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH均為12的燒堿溶液與氫氧化鋇溶液的物質的量濃度之比 | |
| B. | 硫化鉀溶液中c(K+)與c(S2-)之比 | |
| C. | 相同溫度下0.2mol/L醋酸溶液與0.1mol/L醋酸溶液中c(H+)之比 | |
| D. | 10mL 0.5mol•L-1的鹽酸溶液與5mL 0.5mol•L-1的醋酸溶液中的n(H+)之比 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 室溫下c(NH4+)相同的下列溶液:①NH4Al(SO4)2②NH4Cl③CH3COONH4,物質的量濃度由大到小的順序為②>①>③ | |
| B. | 0.001mol•L-1氯水中:c(Cl2)+c(Cl-)+c(ClO-)+c(HClO)=0.01mol•L-1 | |
| C. | amol•L-1的醋酸與0.01mol•L-1的氫氧化鈉溶液等體積混合后呈中性,則醋酸的Ka=5×10-10/(a/2-0.005) | |
| D. | 向5mL含KCl和Kl濃度均為0.01mol•L-1的混合溶液中,滴加8mL0.01mol•L-1的AgNO3溶液,所得溶液中離子濃度大小關系為c(NO3-)>c(K+)>c(Cl-)>c(I-)>c(Ag+) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.5mol的K+ | B. | 0.5mol的H+ | C. | 1.0mol的H+ | D. | 1.0mol的OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 流出溶液的體積為(m-n)mL | B. | 流出溶液的體積為(n-m)mL | ||
| C. | 管內溶液體積等于(a-n)mL | D. | 管內溶液體積多于nmL |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com