
 2Z;
2Z;分析 I.(2)CaO與水反應生成氫氧化鈣,為化合反應,據此分析反應吸放熱;NO2氣體中存在平衡:2NO2(g)?N2O4(g)△H<0,故升高溫度,平衡左移,據此分析;
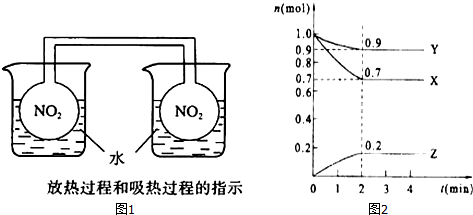
II.(1)根據物質的量的變化判斷反應物和生成物,根據物質的量的變化之比等于化學計量數之比書寫方程式;
(2)反應達平衡時,正反應速率等于逆反應速率,故任何一種物質的生成速率和其消耗速率相等,故任意一種物質的物質的量、物質的量濃度、質量分數、體積分數等均保持不變,據此分析;
(3)轉化率=$\frac{反應掉的物質的量}{總的物質的量}$×100%.
解答 解:I.(2)CaO與水反應生成氫氧化鈣,反應方程式為CaO+H2O═Ca(OH)2,該反應為化合反應,故為放熱反應;NO2氣體中存在平衡:2NO2(g)?N2O4(g)△H<0,故升高溫度,平衡左移,NO2的百分含量增大,故氣體顏色變深,
故答案為:放熱;深;
II.(1)由圖象可以看出,反應中X、Y的物質的量減小,Z的物質的量增多,則X、Y為反應物,Z為生成物,且△n(X):△n(Y):△n(Z)=0.1mol:0.3mol:0.2mol=1:3:2,則反應的化學方程式為:X+3Y  2Z,
2Z,
故答案為:X+3Y  2Z;
2Z;
(2)反應達平衡時,正反應速率等于逆反應速率,故任何一種物質的生成速率和其消耗速率相等,故任意一種物質的物質的量、物質的量濃度、質量分數、體積分數等均保持不變.
A、X、Y、Z三種物質的濃度不再改變,但不一定相等,故A錯誤;
B、存在化學平衡的反應為可逆反應,故均進行不徹底,故X和Y不能完全轉化為Z,故B錯誤;
C.由于平衡時,任何一種物質的生成速率和其消耗速率相等,故反應混合物中Y的轉化率不再變化,故C正確;
D.反應達平衡時,反應沒有停止,只是正反應速率等于逆反應速率,故D錯誤;
故選C;
(3)X的轉化率=$\frac{反應掉的物質的量}{總的物質的量}$×100%=$\frac{0.3mol}{1mol}×100%$=30%,故答案為:30%.
點評 本題考查化學平衡圖象分析題目,題目難度不大,注意分析各物質的量的變化曲線,把握化學方程式的判斷方法.


 鷹派教輔銜接教材河北教育出版社系列答案
鷹派教輔銜接教材河北教育出版社系列答案 初中暑期銜接系列答案
初中暑期銜接系列答案科目:高中化學 來源: 題型:多選題
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.15mol/L | D. | 0.05mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
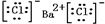 ,⑤的電子式是
,⑤的電子式是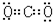 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若反應物總能量大于生成物總能量則反應為放熱反應 | |
| B. | 電池工作時將化學能轉變成電能 | |
| C. | 綠色植物光合作用過程中太陽能轉變成化學能 | |
| D. | 生物質能只能通過含有生物質能的物質的直接燃燒轉化成熱能從而被利用 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 砹是有色固體 | B. | 砹易溶于有機溶劑 | ||
| C. | H2很難與砹化合 | D. | HAt比HCl穩定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③④② | B. | ①③②④ | C. | ③④②① | D. | ③①②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
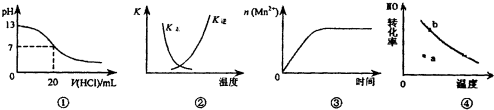
| A. | 圖①表示25℃時,用0.1 mol•L-1鹽酸滴定20 mL 0,1 mol•L-1 NaOH溶液,溶液的pH隨加入酸體積的變化 | |
| B. | 圖②中曲線表示反應2SO2(g)+O2(g)?2SO3(g):△H<0正、逆反應的平衡常數K隨溫度的變化 | |
| C. | 圖③表示10 mL 0.01 mol•L-1 KMnO4酸性溶液與過量的0.1 mol•L-1 H2C2O4溶液混合時,n(Mn2+)隨時間的變化 | |
| D. | 圖④曲線表示2NO+O2?2NO2中NO的最大轉化率與溫度的關系,a點表示未達到平衡狀態,且v(正)<v(逆) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com