
 室溫下,濃度均為0.10mol/L,體積均為V0的MOH和ROH溶液,分別加水稀釋至體積V,pH隨lg$\frac{V}{{V}_{0}}$的變化如圖所示.下列敘述正確的是( )
室溫下,濃度均為0.10mol/L,體積均為V0的MOH和ROH溶液,分別加水稀釋至體積V,pH隨lg$\frac{V}{{V}_{0}}$的變化如圖所示.下列敘述正確的是( )| A. | 稀釋前兩溶液的Ka:MOH溶液>ROH溶液 | |
| B. | ROH的電離程度:b點小于a點 | |
| C. | 兩溶液在稀釋過程中,c(H+)均逐漸減少 | |
| D. | 當lg$\frac{V}{{V}_{0}}$=2時,若兩溶液同時升高溫度,則$\frac{c({R}^{+})}{c({M}^{+})}$增大 |
分析 A.0.10mol/LMOH的pH=13,則MOH為強堿;
B.弱電解質在水溶液中隨著濃度的減小其電離程度增大;
C.若兩種溶液稀釋,溶液中c(OH-)逐漸減小;
D.MOH的堿性強于ROH的堿性,當lg$\frac{V}{{V}_{0}}$=2時,若兩溶液同時升高溫度,促進弱電解質電離.
解答 解:A.0.10mol/LMOH的pH=13,則MOH為強堿,強堿在溶液中完全電離,不存在電離平衡常數,故A錯誤;
B.由圖示可以看出ROH為弱堿,弱電解質在水溶液中隨著濃度的減小其電離程度增大,b點溶液體積大于a點,所以b點濃度小于a點,則ROH電離程度:b>a,故B錯誤;
C.若兩種溶液稀釋,溶液中c(OH-)逐漸減小,溫度不變,Kw不變,所以c(H+)均逐漸增大,故C錯誤;
D.根據A知,堿性MOH>ROH,當lg$\frac{V}{{V}_{0}}$=2時,由于ROH是弱電解質,升高溫度能促進ROH的電離,則c(R+)增大,c(M+)幾乎不變,所以$\frac{c({R}^{+})}{c({M}^{+})}$增大,故D正確;
故選D.
點評 本題考查弱電解質在水溶液中電離平衡,題目難度中等,明確弱電解質電離特點、弱電解質電離程度與溶液濃度關系等知識點是解本題關鍵,側重于考查學生的分析能力.


 中考解讀考點精練系列答案
中考解讀考點精練系列答案科目:高中化學 來源: 題型:選擇題
 用如圖裝置制取、提純并收集下表中的四種氣體(a、b、c表示相應儀器中加入的試劑),其中可行的是( )
用如圖裝置制取、提純并收集下表中的四種氣體(a、b、c表示相應儀器中加入的試劑),其中可行的是( ) | 氣體 | a | b | C | |
| A | NO2 | 濃硝酸 | 銅片 | NaOH溶液 |
| B | CO2 | 稀硫酸 | 石灰石 | 飽和NaHCO3溶液 |
| C | 02 | 雙氧水 | 二氧化錳 | 濃硫酸 |
| D | NH3 | 濃氨水 | 生石灰 | 堿石灰 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
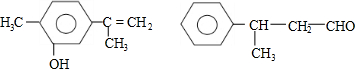
| A. | 可用紅外光譜區分,但不能用核磁共振氫譜區分 | |
| B. | 分子中最多都有10個碳原子共平面 | |
| C. | 不是同分異構體 | |
| D. | 均能與溴水反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
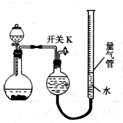 某同學設計如圖所示裝置分別進行探究實驗(夾持裝置已略去),請回答下列問題:
某同學設計如圖所示裝置分別進行探究實驗(夾持裝置已略去),請回答下列問題:| 實驗 | 藥品 | 制取氣體 | 量氣管中液體 |
| Ⅰ | Cu、稀HNO3 | NO | H2O |
| Ⅱ | NaOH(s)、濃氨水 | NH3 | |
| Ⅲ | 過氧化鈉、水 | O2 | H2O |
| Ⅳ | 鎂鋁合金、NaOH溶液 | H2 | H2O |

| 編號 | 鎂鋁合金 | 量氣管第一次讀數 | 量氣管第二次讀數 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
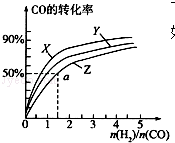 甲醇是重要的燃料,有廣闊的應用前景:工業上一般以CO和為原料合成甲醇,該反應的熱化學方程式為:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有廣闊的應用前景:工業上一般以CO和為原料合成甲醇,該反應的熱化學方程式為:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | m+n<p | B. | 平衡向逆反應方向移動 | ||
| C. | C的體積分數增大 | D. | A的轉化率降低 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亞硫酸 |
| 電離平衡常數 | Ka=1.75×10-5 | Ka=4.2×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 等物質的量濃度的四種酸溶液中,pH最大的是亞硫酸 | |
| B. | 等物質的量濃度的CH3COONa、NaClO、Na2CO3和Na2SO3 四種溶液中,堿性最強的是Na2CO3 | |
| C. | 少量CO2通入NaClO溶液中反應的離子方程式為:CO2+H2O+2ClO-═$CO_3^{2-}$+2HClO | |
| D. | 醋酸與NaHSO3溶液反應的離子方程式為:CH3COOH+HSO3-═SO2+H2O+CH3COO- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
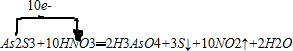 ;
;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com