
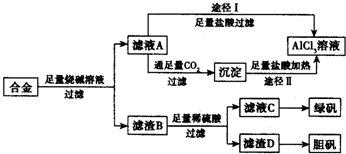
 工業上用含有鋁、鐵、銅的合金工業廢料制取純凈的氯化鋁溶液、綠礬晶體(FeSO4•7H2O) 和膽礬晶體(CuSO4•5H2O)設計了如下方案如圖所示:請回答相關問題:
工業上用含有鋁、鐵、銅的合金工業廢料制取純凈的氯化鋁溶液、綠礬晶體(FeSO4•7H2O) 和膽礬晶體(CuSO4•5H2O)設計了如下方案如圖所示:請回答相關問題:分析 流程題的關鍵是明確流程中每一步的反應過程,前后連貫綜合考慮解答問題,鋁、鐵、銅的合金中加入足量燒堿溶液過濾,得到濾液A為偏鋁酸鈉溶液,濾渣B為鐵和銅,由濾液A加入足量鹽酸反應制取AlCl3溶液,同時A中含有Na+,該途徑是不行的,制取的AlCl3中含有雜質;濾液A中通入足量二氧化碳和偏鋁酸鈉溶液反應生成氫氧化鋁沉淀,過濾得到沉淀中加入足量鹽酸加熱通過途徑Ⅱ得到氯化鋁溶液;濾渣B中加入足量硫酸溶液鐵反應生成硫酸亞鐵溶液,銅不反應,過濾得到濾液C為硫酸亞鐵溶液,從濾液C中獲得綠礬晶體注意的是冷卻結晶,不是蒸發結晶,濾渣D為銅,通過氧化生成氧化銅,氧化銅和硫酸反應生成硫酸銅溶液,濃縮蒸發,冷卻結晶,過濾洗滌得到膽礬,
(1)合金溶于足量燒堿溶液時發生反應生成偏鋁酸鈉和氫氣,途徑I中是過量氫氧化鈉和鹽酸發生反應生成氯化鈉和水,偏鋁酸鈉溶液和鹽酸反應得到氯化鋁、氯化鈉的混合溶液;
(2)由濾液A得AlCl3溶液的途徑有I和II兩種,分析可知由濾液A加入足量鹽酸反應制取AlCl3溶液,同時A中含有Na+,該途徑Ⅰ是不行的,途徑Ⅱ可以得到氯化鋁溶液,
(3)在濾渣D中加入稀硫酸和H2O2來制備膽礬晶體是一種綠色工藝,銅和過氧化氫扎起稀硫酸溶液中發生氧化還原反應生成硫酸銅溶液,結合反應的定量關系計算得到需要氧化劑過氧化氫的物質的量;
(4)利用溶液中溶質分離的方法回答,硫酸亞鐵溶液蒸發濃縮,冷卻結晶,過濾洗滌得到晶體.
解答 解:(1)合金溶于足量燒堿溶液時發生反應生成偏鋁酸鈉和氫氣,反應的離子方程式為:2Al+2OH-+2H2O═2AlO2-+3H2↑,途徑I中是過量氫氧化鈉和鹽酸發生反應生成氯化鈉和水,反應的離子方程式為:H++OH-═H2O,偏鋁酸鈉溶液和鹽酸反應得到氯化鋁、氯化鈉的混合溶液,反應的離子方程式為:AlO2-+4H+═Al3++2H2O,
故答案為:2Al+2OH-+2H2O═2AlO2-+3H2↑;AlO2-+4H+═Al3++2H2O、H++OH-═H2O;
(2)濾液A為偏鋁酸鈉溶液,濾渣B為鐵和銅,由濾液A加入足量鹽酸反應制取AlCl3溶液,同時A中含有Na+,該途徑是不行的,制取的AlCl3中含有雜質;濾液A中通入足量二氧化碳和偏鋁酸鈉溶液反應生成氫氧化鋁沉淀,過濾得到沉淀中加入足量鹽酸加熱通過途徑Ⅱ得到氯化鋁溶液,途徑Ⅱ更合理,因為濾液A是NaAlO2溶液,按途徑Ⅰ直接向A加入鹽酸得到的AlCl3溶液中含有大量的NaCl雜質;按途徑Ⅱ,通入CO2氣體,得Al(OH)3 沉淀,將Al(OH)3溶解于鹽酸中得到的是較純凈的AlCl3溶液;
故答案為:Ⅱ;因為濾液A是NaAlO2溶液,按途徑Ⅰ直接向A加入鹽酸得到的AlCl3溶液中含有大量的NaCl雜質;按途徑Ⅱ,通入CO2氣體,得Al(OH)3 沉淀,將Al(OH)3溶解于鹽酸中得到的是較純凈的AlCl3溶液;
(3)H2O2是一種綠色氧化劑,在濾渣D中加入稀硫酸和H2O2來制備膽礬晶體,稀硫酸和H2O2溶解濾渣D的離子方程式為:Cu+H2O2+2H+═Cu2++2H2O,制取500g膽礬物質的量=$\frac{500g}{250g/mol}$=2mol,需要的氧化劑過氧化氫的物質的量為2mol,
故答案為:Cu+H2O2+2H+═Cu2++2H2O;2mol;
(4)從濾液C中獲得綠礬晶體,硫酸亞鐵溶液蒸發濃縮,冷卻結晶,過濾洗滌得到晶體,故答案為:蒸發、濃縮、冷卻結晶.
點評 本題考查了物質性質的分析,流程分析判斷,主要是物質性質轉化的理解應用,掌握基礎是解題關鍵,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1mol氧氣中含有12.04×1023個氧原子,在標準狀況下占有體積22.4L | |
| B. | 1mol臭氧和1.5mol氧氣含有相同的氧原子數 | |
| C. | 等體積、濃度均為1mol•L-1的磷酸和鹽酸,電離出的氫離子數之比為3:1 | |
| D. | 等物質的量的干冰和葡萄糖中所含碳原子數之比為1:6,氧原子數之比為1:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖是一組探究氯氣性質的裝置.
如圖是一組探究氯氣性質的裝置.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
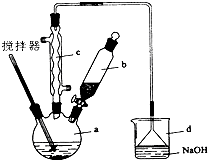 實驗室制備苯乙酮的化學方程式為:
實驗室制備苯乙酮的化學方程式為: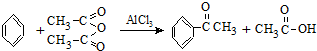
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
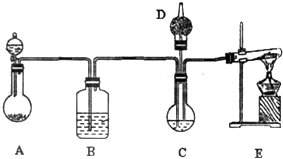 納米碳酸鈣有廣泛的應用前景.用下圖所示裝置,在濃CaCl2溶液中通入NH3和CO2可制得納米級碳酸鈣.D中裝有蘸稀硫酸的脫脂棉,圖中夾持裝置已略去.
納米碳酸鈣有廣泛的應用前景.用下圖所示裝置,在濃CaCl2溶液中通入NH3和CO2可制得納米級碳酸鈣.D中裝有蘸稀硫酸的脫脂棉,圖中夾持裝置已略去.
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2(g),隨溫度升高,混合氣體的顏色變深.回答下列問題:
在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2(g),隨溫度升高,混合氣體的顏色變深.回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com