
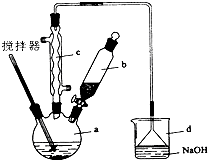
 實驗室制備苯乙酮的化學方程式為:
實驗室制備苯乙酮的化學方程式為: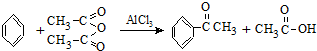
分析 利用酯化反應原理制備苯乙酮,反應過程中要控制反應溫度并冷凝反應物的蒸汽,提高反應物的利用率,收集產物里要安全措施,收集到的生成物進行分離提純,涉及分液操作的要點;
(1)反應混合加熱時因苯易揮發,如果沒有c裝置會進與生成物混在一起,加深了分離提純難度,且反應物的利用率低,故運用c裝置通過冷凝,再重新回到反應容器中,裝置d是收集苯乙酮,用倒置的三角漏斗達到防倒吸的目的;
(2)苯乙酮也能微溶于水,利用苯萃取可減少產物的損失,另外萃取原理是利用物質在互不相溶的溶劑中的溶解度不同,對混合溶液進行分離;
(3)分液漏斗分離的是互不相溶的液體混合物,可結合操作的本質和注意點分析判斷.
解答 解:(1)裝置c是冷凝管,可將受熱揮發出的苯蒸汽冷凝重新回流到反應容器中,可提高原料的利用率,也減輕生成物的分離提純難度,d裝置是利用倒置的三角漏斗收集苯乙酮,即增大了接受面積,也達到防倒吸的目的,故答案為:冷凝回流原料;防止倒吸;
(2)水層用苯萃取并分液的目的是把溶解在水中的苯乙酮提取出來以減少損失,由于乙醇能與水混溶不分層,所以不能用酒精代替苯進行萃取操作,故答案為:把溶解在水中的苯乙酮提取出來以減少損失;乙醇與水混溶;
(3)用苯萃取時因苯的密度小,振蕩靜置分層后,苯層在上層,打開分液漏斗下面的活塞,只能讓下層液體流出,上層苯層從從分液漏斗上口倒出,故答案為:上;從分液漏斗上口倒出,
故答案為:檢漏;放氣;打開上口玻璃塞;
點評 本題考查了物質制備、分離、提純、萃取劑選擇、儀器使用等試驗基礎知識的應用,化學實驗基本知識和基本技能的掌握是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 向盛有10mL水的量筒中倒入濃硫酸即得稀硫酸 | |
| B. | 向試管中滴加試劑時,將滴管下端緊靠試管內壁 | |
| C. | 使用試紙檢驗溶液的性質時,將試紙浸入溶液中 | |
| D. | 用托盤天平稱量藥品時,左盤放藥品,右盤放砝碼 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | M與A均能使酸性高錳酸鉀溶液和溴水褪色 | |
| B. | B能發生消去、氧化、取代、縮聚等反應 | |
| C. | 1molM與足量燒堿溶液反應,可消耗2nmolNaOH | |
| D. | A、B、C各1mol分別與金屬鈉反應,放出氣體的物質的量之比為1:2:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1L1mol•L-1的Na2CO3溶液中含有CO32-的數目為NA | |
| B. | 28g的乙烯和丙烯中含碳原子數目為NA | |
| C. | 標準狀況下,6.72LNO2與水充分反應轉移的電子數目為0.1NA | |
| D. | 常溫常壓下,14g由N2與CO組成混合氣體含有的原子數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 在實驗室中某實驗小組同學關于硫酸銅的制取和應用,設計了以下實驗:
在實驗室中某實驗小組同學關于硫酸銅的制取和應用,設計了以下實驗:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
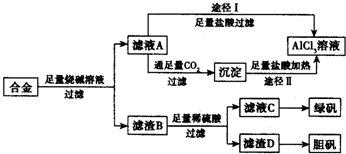 工業上用含有鋁、鐵、銅的合金工業廢料制取純凈的氯化鋁溶液、綠礬晶體(FeSO4•7H2O) 和膽礬晶體(CuSO4•5H2O)設計了如下方案如圖所示:請回答相關問題:
工業上用含有鋁、鐵、銅的合金工業廢料制取純凈的氯化鋁溶液、綠礬晶體(FeSO4•7H2O) 和膽礬晶體(CuSO4•5H2O)設計了如下方案如圖所示:請回答相關問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 二氧化碳是造成溫室效應的主要氣體,二氧化碳的回收再利用是減緩溫室效應的有效途徑之一.
二氧化碳是造成溫室效應的主要氣體,二氧化碳的回收再利用是減緩溫室效應的有效途徑之一.| 溫度/K CO2轉化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
 溫度為T時,向2.0L恒容密閉容器中充入1.0mol PCl5,反應PCl5(g)?PCl3(g)+Cl2(g)經過一段時間后達到平衡.反應過程中測定的n(PCl3)隨時間的變化如圖,下列說法正確的是( )
溫度為T時,向2.0L恒容密閉容器中充入1.0mol PCl5,反應PCl5(g)?PCl3(g)+Cl2(g)經過一段時間后達到平衡.反應過程中測定的n(PCl3)隨時間的變化如圖,下列說法正確的是( )| A. | 反應在前50s的平均速率v(PCl5)=0.0032 mol•L-1•s-1 | |
| B. | 該反應的平衡常數K=0.025 | |
| C. | 相同溫度下,起始時向容器中充入1.0molPCl5、0.20molPCl3 和0.20mol Cl2,反應達到平衡前v(正)>v(逆) | |
| D. | 保持其他條件不變,升高溫度,平衡時:c(PCl3)=0.11mol•L-1,則反應的△H<0 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com