
分析 (1)根據硅原子電子排布式:1s22s22p63s23p2確定能級,根據洪特確定自旋方向;SiO2晶體中每個硅原子與4個氧原子形成4個Si-O共價鍵;
(2)非金屬性越強,單質的氧化性越強;減少生成物的濃度,平衡正向移動;
(3)四氯化硅是正四面體結構,分子結構對稱的是非極性分子;
(4)體積減小,壓強增大,平衡正向移動,氯氣的物質的量減小,但體積減小更大,濃度增大;
(5)根據v=$\frac{△C}{△t}$來求出氯氣的速率,再根據速率之比等于化學計量數之比來解答;
(6)降低壓強向體積增大的方向移動,升高溫度向吸熱方向移動,減少生成物的濃度,平衡正向移動.
解答 解:(1)硅原子電子排布式:1s22s22p63s23p2,核外有5種不同能級的電子,當電子排布在同一能級的不同軌道時,基態(tài)原子中的電子總是優(yōu)先占據不同軌道,而且自旋方向相同,最外層的p電子有1種自旋方向;SiO2晶體中每個硅原子與4個氧原子形成4個Si-O共價鍵;
故答案為:5;1;4;
(2)非金屬性越強單質的氧化性越強,碳的還原性弱于硅;減少生成物CO的濃度,平衡正向移動;
故答案為:弱于;因為生成物CO為氣態(tài),降低CO的濃度,可使平衡正向移動;
(3)四氯化硅是正四面體結構,SiCl4分子結構對稱結構,屬于非極性分子;
故答案為:正四面體型;非極性;
(4)體積減小,壓強增大,平衡正向移動,氯氣的物質的量減小,但體積減小更大,濃度增大;
故答案為:小于;
(5)氯氣的反應速率v(Cl2)=$\frac{△C}{△t}$=$\frac{2a-b}{t}$mol/(L•s),v(SiCl4)=$\frac{1}{2}$v(Cl2)=$\frac{2a-b}{2t}$mol/(L•s);
故答案為:$\frac{2a-b}{2t}$mol/(L•s);
(6)降低壓強;升高溫度;及時分離出HCl使平衡正向移動;
故答案為:降低壓強;升高溫度(或及時分離出HCl等).
點評 本題涉及知識點較多,考查原子結構、還原性比較、電子式和平衡移動、化學反應速率等,難度中等,注意掌握平衡移動原理是解題的關鍵.


 超能學典單元期中期末專題沖刺100分系列答案
超能學典單元期中期末專題沖刺100分系列答案 黃岡360度定制密卷系列答案
黃岡360度定制密卷系列答案 陽光考場單元測試卷系列答案
陽光考場單元測試卷系列答案 名校聯(lián)盟沖刺卷系列答案
名校聯(lián)盟沖刺卷系列答案科目:高中化學 來源: 題型:解答題
 A、B、C、D、E、F均屬前四周期且原子序數依次增大的六種元素,其中A、B、C是同一周期相鄰的三種元素,B的氫化物易溶于C的氫化物中,D的基態(tài)原子s軌道與p軌道上的電子數之比為2:3,且D為主族元素;E、F為副族元素,4s能級均只有一個電子.回答下列問題:
A、B、C、D、E、F均屬前四周期且原子序數依次增大的六種元素,其中A、B、C是同一周期相鄰的三種元素,B的氫化物易溶于C的氫化物中,D的基態(tài)原子s軌道與p軌道上的電子數之比為2:3,且D為主族元素;E、F為副族元素,4s能級均只有一個電子.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CaCl2溶液中通入CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 酸性KMnO4溶液中通入SO2:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ | |
| C. | FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | AgCl懸濁液中通HI:Ag++HI═AgI↓+H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 )的合成路線如下:
)的合成路線如下: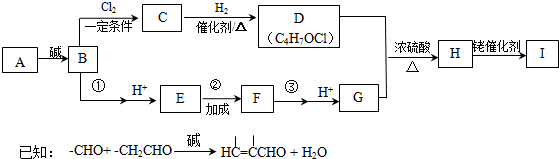
 ,B→C的反應類型為取代反應.
,B→C的反應類型為取代反應. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol SO2 (g)的能量總和大于1 mo S(s)和1 mol O2(g)的能量總和 | |
| B. | 加入合適的催化劑,可增加單位質量的硫燃燒放出的熱量 | |
| C. | S(g)+O2(g)→SO2(g)+Q1 kJ;Q1的值大于297.23 | |
| D. | 足量的硫粉與標況下1升氧氣反應生成1升二氧化硫氣體時放出297.23 kJ熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 只閉合K2,該裝置將電能轉化為化學能 | |
| B. | 只閉合K1,石墨棒周圍溶液pH逐漸升高 | |
| C. | 只閉合K2,鐵棒不會被腐蝕,屬于犧牲陽極的陰極保護法 | |
| D. | 鐵腐蝕的速度由大到小的順序是:只閉合K1>都斷開>只閉合K2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 H2SO3; H2SO3
H2SO3; H2SO3  H++HSO3-;HSO3-
H++HSO3-;HSO3-  H++SO32-.
H++SO32-.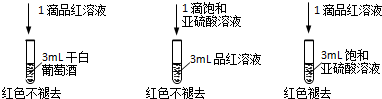
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com