
 A、B、C、D、E、F均屬前四周期且原子序數依次增大的六種元素,其中A、B、C是同一周期相鄰的三種元素,B的氫化物易溶于C的氫化物中,D的基態原子s軌道與p軌道上的電子數之比為2:3,且D為主族元素;E、F為副族元素,4s能級均只有一個電子.回答下列問題:
A、B、C、D、E、F均屬前四周期且原子序數依次增大的六種元素,其中A、B、C是同一周期相鄰的三種元素,B的氫化物易溶于C的氫化物中,D的基態原子s軌道與p軌道上的電子數之比為2:3,且D為主族元素;E、F為副族元素,4s能級均只有一個電子.回答下列問題:分析 A、B、C、D、E、F均屬前四周期且原子序數依次增大的六種元素,其中A、B、C是同一周期相鄰的三種元素,B的氫化物易溶于C的氫化物中,B為N元素,C為O元素,A應為C元素,D的基態原子s軌道與p軌道上的電子數之比為2:3,應為P元素,核外電子排布為1s22s22p63s22p3,E、F為副族元素,4s能級均只有一個電子,核外電子排布式分別為:1s22s22p63s22p63d54s1、1s22s22p63s22p63d104s1,則E為Cr元素、F為Cu元素,據此進行解答(1)~(5);
(6)①高溫下,B的三溴化物和P的三溴化物在氫氣的氛圍中合成BP,根據反應物、生成物及反應條件書寫方程式;
②晶體中B與P原子的最近距離為anm,即a×10-7cm, ,圖中1、2、3、4原子形成正四面體結構,這四個原子之間的B原子位于正四面體體心上,1、5原子之間的距離為a×10-7cm,頂點到體心距離與體心到底面距離之比為3:1,則其高為$\frac{4}{3}$×a×10-7cm,設1、2原子之間距離為x,1、2、3原子形成的正三角形底面的高=$\frac{\sqrt{3}}{2}$x,正三角形頂點到中心的距離與中心到底的距離之比為2:1,所以正三角形頂點到中心的距離=$\frac{\sqrt{3}}{2}$x×$\frac{2}{3}$=$\frac{\sqrt{3}}{3}$x,由1、2、5構成直角三角形中存在x2=($\frac{\sqrt{3}}{3}$x)2+($\frac{4}{3}$×a×10-7)2,x=$\frac{2\sqrt{6}}{3}$×a×10-7,則晶胞棱長=$\sqrt{\frac{(2x)^{2}}{2}}$cm=$\frac{4}{\sqrt{3}}a×1{0}^{-7}$cm,晶胞體積=($\frac{4}{\sqrt{3}}a×1{0}^{-7}$)3cm3,
,圖中1、2、3、4原子形成正四面體結構,這四個原子之間的B原子位于正四面體體心上,1、5原子之間的距離為a×10-7cm,頂點到體心距離與體心到底面距離之比為3:1,則其高為$\frac{4}{3}$×a×10-7cm,設1、2原子之間距離為x,1、2、3原子形成的正三角形底面的高=$\frac{\sqrt{3}}{2}$x,正三角形頂點到中心的距離與中心到底的距離之比為2:1,所以正三角形頂點到中心的距離=$\frac{\sqrt{3}}{2}$x×$\frac{2}{3}$=$\frac{\sqrt{3}}{3}$x,由1、2、5構成直角三角形中存在x2=($\frac{\sqrt{3}}{3}$x)2+($\frac{4}{3}$×a×10-7)2,x=$\frac{2\sqrt{6}}{3}$×a×10-7,則晶胞棱長=$\sqrt{\frac{(2x)^{2}}{2}}$cm=$\frac{4}{\sqrt{3}}a×1{0}^{-7}$cm,晶胞體積=($\frac{4}{\sqrt{3}}a×1{0}^{-7}$)3cm3,
該晶胞中B原子個數為4、P原子個數=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,再根據密度=$\frac{m}{V}$計算.
解答 解:A、B、C、D、E、F均屬前四周期且原子序數依次增大的六種元素,其中A、B、C是同一周期相鄰的三種元素,B的氫化物易溶于C的氫化物中,B為N元素,C為O元素,A應為C元素,D的基態原子s軌道與p軌道上的電子數之比為2:3,應為P元素,核外電子排布為1s22s22p63s22p3,E、F為副族元素,4s能級均只有一個電子,核外電子排布式分別為:1s22s22p63s22p63d54s1、1s22s22p63s22p63d104s1,則E為Cr元素、F為Cu元素,
(1)同一周期中,原子序數越大,電負性越小,則三種元素按電負性由小到大的順序為:C O N或C<O<N,
故答案為:C O N或C<O<N;
(2)B為N元素,與氧元素形成的四原子陰離子為NO3-,NO3-離子中C原子價層電子對數=3+$\frac{5+1-2×3}{2}$=3,且N原子不含孤電子對,所以其空間構型為平面三角形,原子采用sp2雜化;其三氯化物為NCl3,其分子中含有3個單鍵和1個孤對電子,其分子中N原子采用sp3雜化,分子的立體構型為三角錐形,
故答案為:sp2;三角錐形;
(3)原子個數相等、價電子數相等的微粒互為等電子體,與CN-離子互為等電子體的有:C22-或O22+,
故答案為:C22-或O22+;
(4)F除最外層原子軌道處于半充滿狀態,其余能層均充滿電子,為Cu,原子序數為29,原子核外電子排布為:1s22s22p63s23p63d104s1,外圍電子排布式為:3d104s1,Cu晶體屬于面心立方最密堆積,為ABC型排列方式,故④符合,
故答案為:3d104s1;④;
(5)向1.0mol該晶體的溶液中加入足量AgNO3溶液產生143.5g白色沉淀,該白色沉淀為AgCl,其物質的量為:$\frac{143.5g}{143.5g/mol}$=1mol,說明在該化合物中含有1個氯離子,Cr3+、Cl-、H2O的物質的量之比為1:3:6,則配位離子中含有氯離子數為:3-1=2,配位離子中含有水為:6-2=4,則含有結晶水水的個數為:6-4=2,故該配位化合物的化學式為:[Cr(H2O)4Cl2]Cl•2H2O,
故答案為:[Cr(H2O)4Cl2]Cl•2H2O;
(6)①高溫下,B的三溴化物和P的三溴化物在氫氣的氛圍中合成BP,根據反應物、生成物及反應條件書寫方程式為BBr3+PBr3+3H2$\frac{\underline{\;高溫\;}}{\;}$BP+6HBr,
故答案為:BBr3+PBr3+3H2 $\frac{\underline{\;高溫\;}}{\;}$ BP+6HBr;
②晶體中B與P原子的最近距離為apm,即a×10-7cm, ,圖中1、2、3、4原子形成正四面體結構,這四個原子之間的B原子位于正四面體體心上,1、5原子之間的距離為a×10-7cm,頂點到體心距離與體心到底面距離之比為3:1,則其高為$\frac{4}{3}$×a×10-7cm,設1、2原子之間距離為x,1、2、3原子形成的正三角形底面的高=$\frac{\sqrt{3}}{2}$x,正三角形頂點到中心的距離與中心到底的距離之比為2:1,所以正三角形頂點到中心的距離=$\frac{\sqrt{3}}{2}$x×$\frac{2}{3}$=$\frac{\sqrt{3}}{3}$x,由1、2、5構成直角三角形中存在:x2=($\frac{\sqrt{3}}{3}$x)2+($\frac{4}{3}$×a×10-7)2,解得:x=$\frac{2\sqrt{6}}{3}$×a×10-7,則晶胞棱長=$\sqrt{\frac{(2x)^{2}}{2}}$cm=$\frac{4}{\sqrt{3}}a×1{0}^{-7}$cm,晶胞體積=($\frac{4}{\sqrt{3}}a×1{0}^{-7}$)3cm3,
,圖中1、2、3、4原子形成正四面體結構,這四個原子之間的B原子位于正四面體體心上,1、5原子之間的距離為a×10-7cm,頂點到體心距離與體心到底面距離之比為3:1,則其高為$\frac{4}{3}$×a×10-7cm,設1、2原子之間距離為x,1、2、3原子形成的正三角形底面的高=$\frac{\sqrt{3}}{2}$x,正三角形頂點到中心的距離與中心到底的距離之比為2:1,所以正三角形頂點到中心的距離=$\frac{\sqrt{3}}{2}$x×$\frac{2}{3}$=$\frac{\sqrt{3}}{3}$x,由1、2、5構成直角三角形中存在:x2=($\frac{\sqrt{3}}{3}$x)2+($\frac{4}{3}$×a×10-7)2,解得:x=$\frac{2\sqrt{6}}{3}$×a×10-7,則晶胞棱長=$\sqrt{\frac{(2x)^{2}}{2}}$cm=$\frac{4}{\sqrt{3}}a×1{0}^{-7}$cm,晶胞體積=($\frac{4}{\sqrt{3}}a×1{0}^{-7}$)3cm3,
該晶胞中B原子個數為4、P原子個數為:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
所以該晶胞密度為:$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{42}{{N}_{A}}×4}{(\frac{4}{\sqrt{3}}{×a×1{0}^{-7})}^{3}}$g/cm3=$\frac{4×42}{{N}_{A}×(\frac{4}{\sqrt{3}}a×1{0}^{-10})^{3}}$g/cm3,
故答案為:$\frac{4×42}{{N}_{A}×(\frac{4}{\sqrt{3}}a×1{0}^{-10})^{3}}$.
點評 本題考查了位置結構與性質關系的綜合應用、晶胞的計算,題目難度較大,注意熟練掌握原子結構與元素周期表、元素周期律的關系,推斷元素為解答關鍵,(6)中晶胞計算為難點、易錯點,注意掌握晶胞計算的方法與技巧,試題培養了學生的分析、理解能力及化學計算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
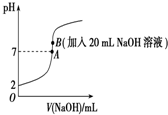 25℃下,向20mL 0.2mol•L-1的氫氟酸中滴加0.2mol•L-1的NaOH溶液時,溶液的pH變化如圖所示,請回答下列問題:
25℃下,向20mL 0.2mol•L-1的氫氟酸中滴加0.2mol•L-1的NaOH溶液時,溶液的pH變化如圖所示,請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4Cl | B. | Mg(HCO3)2 | C. | H2SO4 | D. | MgCl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
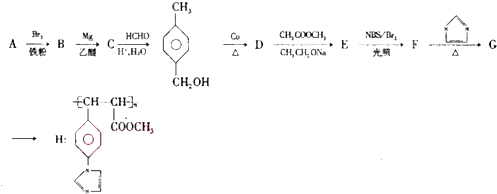



 .
. .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ,該反應屬于消去反應.
,該反應屬于消去反應. .
. .
. 和2個-CH3;
和2個-CH3; 的變化).
的變化). .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol/L CH3COOH溶液與0.1mol/L NaOH溶液等體積混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) | |
| B. | 室溫下,pH=2的鹽酸與pH=12的氨水等體積混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+ )>c(OH-) | |
| C. | 20ml 0.1mol/L CH3COONa溶液與10ml HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | 0.1mol/L NaHCO3溶液與0.1mol/L NaOH溶液等體積混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3- )>c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 ),碳酸亞乙酯可由兩種分子發生酯化反應制取,這兩種分子的原子個數比為( )
),碳酸亞乙酯可由兩種分子發生酯化反應制取,這兩種分子的原子個數比為( )| A. | 3:5 | B. | 1:2 | C. | 2:3 | D. | 2:5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


 .
.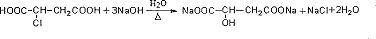 .
. 等.(任寫一種)
等.(任寫一種)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com