
| A. | 25℃時0.1mol/LX2W溶液的pH>1-lg2 | |
| B. | 溶液中水的電離程度:RYX>R2W | |
| C. | 熱穩定性:X2Y>X2W | |
| D. | 由X、Y、Z、W、R五種元素組成的一種化合物可作凈水劑 |
分析 X、Y、Z、W、R是周期表前20號元素,它們的原子序數依次增大,X與Y可形成X2Y和X2Y2兩種液態化合物,為H2O、H2O2,故X為H元素,Y為O元素,Y與W同主族,故W為S元素,Z原子最外電子數是W原子最外層電子數的一半,故Z原子最外層電子數為3,原子序數大于氧元素,故Z為Al元素,R與H元素同主族,原子序數大于S元素,故R為K元素,據此結合選項解答.
解答 解:X、Y、Z、W、R是周期表前20號元素,它們的原子序數依次增大,X與Y可形成X2Y和X2Y2兩種液態化合物,為H2O、H2O2,故X為H元素,Y為O元素,Y與W同主族,故W為S元素,Z原子最外電子數是W原子最外層電子數的一半,故Z原子最外層電子數為3,原子序數大于氧元素,故Z為Al元素,R與H元素同主族,原子序數大于S元素,故R為K元素,
A.H2S屬于弱酸,25℃時0.1mol/LH2S溶液中氫離子濃度小于0.2mol/L,故溶液pH>-lg0.2=1-lg2,故A正確;
B.KOH溶液中氫離子為水電離產生,H2S溶液中氫氧根離子為水產生,二者溶液pH未知,不能判斷KOH溶液中氫離子與硫化氫溶液中氫氧根離子濃度相對大小,即不能確定水的電離程度,故B錯誤;
C.Y為O元素、W為S元素,非金屬性O>S,故熱穩定性:H2O>H2S,故C正確;
D.由H、O、Al、S、K五種元素組成的化合物明礬[KAl(SO4)2.12H2O],溶液中鋁離子水解得到氫氧化鋁膠體,吸附水中的懸浮物質,可以做凈水劑,故D正確;
故選B.
點評 本題考查結構性質位置者關系應用,推斷元素是解題的關鍵,難度中等,B選項為易錯點,學生容易根據強弱電解質比較,而忽略水的電離,注意基礎知識的全面掌握.


科目:高中化學 來源: 題型:解答題
濃度/mol•L-1 時間/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 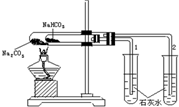 用如圖裝置比較Na2CO3與NaHCO3的穩定性 | |
| B. |  用如圖裝置吸收NH3,并防止倒吸 | |
| C. | 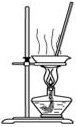 用如圖裝置蒸干AlCl3飽和溶液制備AlCl3晶體 | |
| D. | 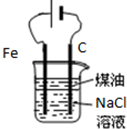 用如圖裝置制取Fe(OH)2沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
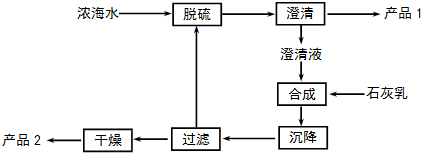
| 離子 | Na+ | Mg2+ | Cl- | SO42- |
| 濃度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 丙烷的二鹵代物是4種,則其六鹵代物是2種 | |
| B. | 對二甲苯的核磁共振氫譜顯示有3種化學環境的氫 | |
| C. | 甲苯苯環上的一個氫原子被含3個碳原子的烷基取代,所得產物有3種 | |
| D. | 某烴的同分異構體只能形成一種一氯代物,其分子式可能為C5H12 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

| TiCl4 | Mg | MgCl2 | Ti | |
| 熔點/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸點/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 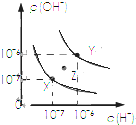 表示不同條件下水的電離平衡曲線,圖中各點溫度:X>Z>Y | |
| B. | 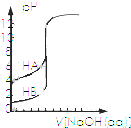 表示濃度相同的兩種一元酸分別用0.1 mol/L NaOH溶液滴定曲線,酸性:HA>HB | |
| C. | 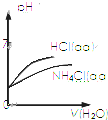 表示pH相同的NH4Cl溶液和HCl溶液分別加同體積水稀釋二者pH的變化曲線 | |
| D. | 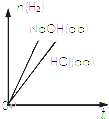 表示向等體積、等物質的量濃度的鹽酸和NaOH溶液中分別加入足量鋁粉,產生H2的物質的量隨時間的變化曲線 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 在密閉容器中,1molH2與1molCO發生反應:CO(g)+2H2(g)?CH3OH(g),△H<0,反應達到平衡時,改變溫度(T)和壓強(P),反應混合物中甲醇的物質的量分數變化情況如圖所示,下列說法正確的是( )
在密閉容器中,1molH2與1molCO發生反應:CO(g)+2H2(g)?CH3OH(g),△H<0,反應達到平衡時,改變溫度(T)和壓強(P),反應混合物中甲醇的物質的量分數變化情況如圖所示,下列說法正確的是( )| A. | P1<P2<P3<P4 | |
| B. | T1<T2<T3<T4 | |
| C. | T4和P1狀態下,H2的平衡轉化率為8/9 | |
| D. | 甲醇的物質的量分數越小,反應的平衡常數越小 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com