
| 離子 | Na+ | Mg2+ | Cl- | SO42- |
| 濃度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
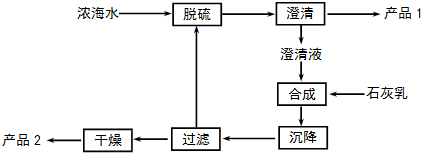
分析 (1)混凝法使的懸浮物質和膠體聚集成較大顆的顆粒而沉淀,然后過濾除去,不能進行海水淡化,通過改變工藝,可以提高部分產品的質量,優化提取產品的品種,可以根據不同的原理改進鉀、溴、鎂等的提取工藝;
(2)從濃海水吹出Br2,并用純堿吸收.溴歧化為Br-和BrO3-并沒有產生CO2則反應生成碳酸氫鈉;
(3)工藝流程合成步驟中加入石灰乳,沉降后,將過濾后的濾液進行脫硫,應是用鈣離子沉淀硫酸根離子生成硫酸鈣沉淀,產品1為硫酸鈣,合成得到氫氧化鎂沉淀,故過濾后干燥的產品2為氫氧化鎂,計算1L溶液中Mg2+的質量,根據Mg2+~Mg(OH)2計算氫氧化鎂的質量;
(4)電解時,若有少量水存在,Mg與水反應生成氫氧化鎂與氫氣,會造成產品鎂的消耗.
解答 解:(1)①混凝法是加入一種混凝劑(如:明礬、鐵鹽等),使水中細小的懸浮物質和膠體聚集成較大顆的顆粒而沉淀,然后過濾除去,海水中可溶性雜質不能除去,不能進行海水淡化,故①錯誤;
②改進工藝,盡可能減少新物質引入,除去粗產品中的雜質,可以提高產品的質量,故②正確;
③海洋是一個遠未完全開發的巨大化學資源寶庫,海水中元素種類很多,改進工藝可以優化提取產品的品種,故③正確;
④根據不同的提取原理可以改進鉀、溴、鎂等的提取工藝,從而提高K、Br2、Mg等的提取質量,故④正確;
故選:②③④;
(2)從濃海水吹出Br2,并用純堿吸收.溴歧化為Br-和BrO3-并沒有產生CO2則反應生成碳酸氫鈉,反應的離子方程式為:3Br2+6CO32-+3H2O=5Br-+BrO3-+6HCO3-;
故答案為:3Br2+6CO32-+3H2O=5Br-+BrO3-+6HCO3-;
(3)工藝流程合成步驟中加入石灰乳,沉降后,將過濾后的濾液進行脫硫,用Ca2+沉淀SO42-生成CaSO4沉淀,離子方程式為:Ca2++SO42-=CaSO4↓,采用過濾的方法得到產品1為CaSO4,濾液中加入石灰乳,發生反應為Mg2+(aq)+Ca(OH)2(s)=Mg(OH)2(s)+Ca2+ (aq),合成中應得到Mg(OH)2沉淀,過濾、干燥的產品2為Mg(OH)2,濃海水的利用率為90%
溶液中m(Mg2+)=1L×90%×28.8g/L=25.92g;
Mg2+~Mg(OH)2
24g 58g
25.92g m[Mg(OH)2]
m[Mg(OH)2]=25.92g×$\frac{58g}{24g}$=62.64g,
故答案為:Ca2+;Mg2+(aq)+Ca(OH)2(s)=Mg(OH)2(s)+Ca2+ (aq);62.64;
(4)電解時,若有少量水存在,Mg與水反應生成氫氧化鎂與氫氣,會造成產品鎂的消耗,反應方程式為:Mg+2H2O$\frac{\underline{\;高溫\;}}{\;}$Mg(OH)2+H2↑,在HCl的氣體氛圍中加熱,抑制MgCl2水解;
故答案為:抑制MgCl2水解.
點評 本題考查海水資源開發利用、氧化還原反應計算、電解原理等知識,對基礎知識能進行綜合運用是解答關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
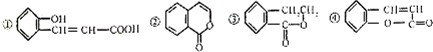
| A. | 只有①能和碳酸鈉反應放出氣體 | B. | ②和④互為同分異構體 | ||
| C. | ①②④都可以使溴水褪色 | D. | ④與H2加成后可以得到③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 與濃氫溴酸鹵代 | B. | 與濃硫酸共熱消去 | ||
| C. | 銅催化氧化 | D. | 與戊酸催化酯化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 25℃時0.1mol/LX2W溶液的pH>1-lg2 | |
| B. | 溶液中水的電離程度:RYX>R2W | |
| C. | 熱穩定性:X2Y>X2W | |
| D. | 由X、Y、Z、W、R五種元素組成的一種化合物可作凈水劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:1 | B. | 2:5 | C. | 3:4 | D. | 5:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 30.8% | B. | 28.6% | C. | 25.3% | D. | 22.7% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com