
 在密閉容器中,1molH2與1molCO發生反應:CO(g)+2H2(g)?CH3OH(g),△H<0,反應達到平衡時,改變溫度(T)和壓強(P),反應混合物中甲醇的物質的量分數變化情況如圖所示,下列說法正確的是( )
在密閉容器中,1molH2與1molCO發生反應:CO(g)+2H2(g)?CH3OH(g),△H<0,反應達到平衡時,改變溫度(T)和壓強(P),反應混合物中甲醇的物質的量分數變化情況如圖所示,下列說法正確的是( )| A. | P1<P2<P3<P4 | |
| B. | T1<T2<T3<T4 | |
| C. | T4和P1狀態下,H2的平衡轉化率為8/9 | |
| D. | 甲醇的物質的量分數越小,反應的平衡常數越小 |
分析 A、增大壓強,平衡正向移動,結合圖象判斷甲醇的物質的量分數變化情況判斷壓強大小;
B、溫度升高,平衡向著吸熱方向進行,反之向著放熱方向進行;
C、根據轉化率等于變化量和初始量的比值,列出三段式進行計算即可;
D、△H<0,升高溫度,平衡逆向移動.
解答 解:A、增大壓強,平衡正向移動,則反應混合物中甲醇(CH3OH)的物質的量分數逐漸增大,即P1>P2>P3>P4,故A錯誤;
B、CO(g)+2H2(g)?CH3OH(g),△H<0,此反應為放熱反應,故升高溫度,甲醇的含量減小,故T1>T2>T3>T4,故B錯誤;
C、T4、P1時,甲醇的物質的量分數是0.4,設消耗氫氣的物質的量是2x,
2H2(g)十CO(g)≒CH3OH(g)
初始量:1 1 0
變化量:2x x x
平衡量:1-2x 1-x x
$\frac{x}{1-2x+1-x+x}$=0.4,解得x=$\frac{4}{9}$,所以H2的平衡轉化率為$\frac{\frac{4}{9}×2}{1}$×100%=$\frac{8}{9}$,故C正確;
D、平衡常數只受溫度的影響,△H<0,升高溫度,平衡逆向移動,甲醇的物質的量分數減小,反應的平衡常數減小,但甲醇的物質的量分數的高低和反應的平衡常數之間沒有關系,故D錯誤;
故選C.
點評 本題考查學生化學平衡的影響因素以及化學平衡的計算知識,屬于綜合知識的考查,難度不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 25℃時0.1mol/LX2W溶液的pH>1-lg2 | |
| B. | 溶液中水的電離程度:RYX>R2W | |
| C. | 熱穩定性:X2Y>X2W | |
| D. | 由X、Y、Z、W、R五種元素組成的一種化合物可作凈水劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 150mL 2mol•L-1 KCl溶液 | B. | 75mL 0.5mol•L-1CaCl2溶液 | ||
| C. | 150mL 1mol•L-1 NaCl溶液 | D. | 75mL 1mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
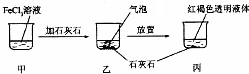
| A. | 反應過程中產生的氣體是CO2 | |
| B. | 丙中液體可產生“丁達爾效應” | |
| C. | 若忽略溶液體積的變化,燒杯中c(Cl- )不發生變化 | |
| D. | 若在丙中加入過量鹽酸,充分反應后所得溶液組成與甲相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{11.2X}{5A}$mol-1 | B. | $\frac{5A}{11.2X}$mol-1 | C. | $\frac{22.4A}{5X}$mol-1 | D. | $\frac{22.4X}{5A}$mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 飽和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手壓住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒轉過來振蕩 | |
| B. | 靜置,待分液漏斗中液體分層后,先使分液漏斗內外空氣相通(準備放出液體) | |
| C. | 打開分液漏斗的活塞,使全部下層液體沿承接液體的燒杯內壁慢慢流出 | |
| D. | 最后繼續打開活塞,另用容器承接并保存上層液體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
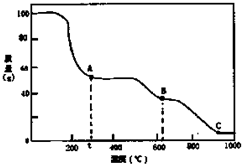
| A. | 0℃→t℃的過程變化是物理變化 | |
| B. | C點物質是工業上冶煉鋁的原料 | |
| C. | A→B反應中生成物只有Al2(SO4)3和NH3兩種 | |
| D. | Al2(SO4)3能夠凈水,其原理為:Al3++3OH?Al(OH)3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com