
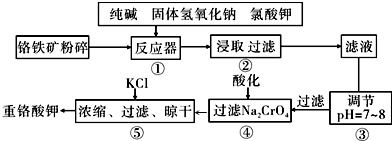
分析 流程分析可知,鉻鐵礦(主要成分為FeO•Cr2O3,雜質為SiO2、Al2O3)為原料粉碎后再反應器中加入純堿、固體氫氧化鈉、氯酸鉀浸取過濾得到濾液調節溶液PH除去鋁和硅酸根離子,過濾得到Na2CrO4溶液,酸化后加入氯化鉀濃縮過濾干燥得到重鉻酸鉀,
(1)依據影響化學反應速率的因素分析,增大接觸面積會加快反應速率;
(2)根據水解平衡移動判斷產物;
(3)在酸性環境下,CrO42-轉化為Cr2O72-,據此來書寫方程式;
(4)操作⑤加入KCl的原因溫度對氯化鈉的溶解度影響小,但對重鉻酸鉀的溶解度影響較大;
(5)根據反應:I2+2S2O32-=2I-+S4O62-,碘單質遇到淀粉時,溶液的藍色消失,據此來回答并計算純度.
解答 解:(1)堿浸前將銘鐵礦粉碎的作用是增大接觸面積加快反應速率;
故答案為:增大接觸面積,增大反應速率;
(2)由于硅酸鈉和偏鋁酸鈉在溶液中發生水解,SiO32-+H2O?HSiO3-+OH-、HSiO3-+H2O?H2SiO3+OH-、AlO2-+2H2O?Al(OH)3+OH-,降低pH有利于水解平衡向正反應方向移動,當pH調到7~8時能使它們完全水解生成沉淀,
故答案為:H2SiO3、Al(OH)3;
(3)在酸性環境下,CrO42-轉化為Cr2O72-,即2CrO42-+2H+?Cr2O72-+H2O;
故答案為:2CrO42-+2H+?Cr2O72-+H2O;
(4)操作⑤加入KCl的原因溫度對氯化鈉的溶解度影響小,但對重鉻酸鉀的溶解度影響較大,利用復分解反應,可得到重鉻酸鉀;
故答案為:溫度對氯化鈉的溶解度影響小,但對重鉻酸鉀的溶解度影響較大,利用復分解反應,可得到重鉻酸鉀;
(5))①根據反應:I2+2S2O32-=2I-+S4O62-,當滴加最后一滴硫代硫酸鈉溶液時,碘單質恰好完全反應,溶液藍色褪去,達到滴定終點,
故答案為:當滴加最后一滴硫代硫酸鈉溶液時,溶液藍色褪去,半分鐘內不變色;
②由反應Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62-可得反應的關系式為Cr2O72-~3I2~6S2O32-,根據關系式計算.
Cr2O72-~3I2~6S2O32-
1mol 3mol 6mol
n 0.1200×40×10-3mol
則250ml含重鉻酸鉀的物質的量為n=$\frac{0.1200×40×10{\;}^{-3}mol}{6}$×10,則所得產品中重鉻酸鉀純度為 $\frac{0.1200×40×1{0}^{-3}×10×294}{6×2.5000}$×100%=94.08%,
故答案為:94.08%.
點評 本題考查較為綜合,涉及氧化還原反應、溶解平衡以及滴定操作等問題,題目難度中等,本題注意從質量守恒的角度利用關系式法計算.


科目:高中化學 來源: 題型:選擇題
| A. | 提高CO2充氣壓力,飲料中c(A-)不變 | |
| B. | 當pH為5.0時,飲料中 $\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| C. | 相比于未充CO2的飲料,碳酸飲料的抑菌能力較低 | |
| D. | 結合H+的能力:A->HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④ | B. | ③⑥ | C. | 只有② | D. | 只有⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
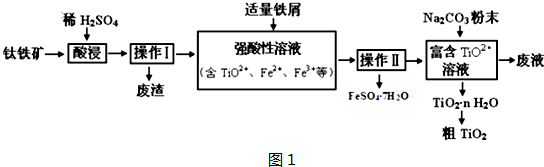
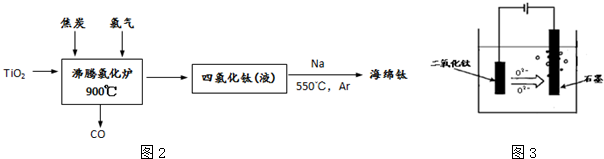
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
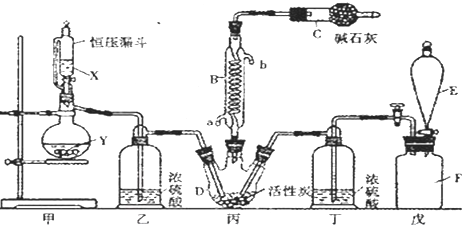
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
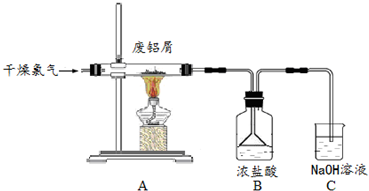
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
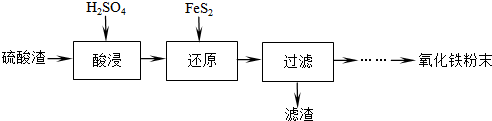
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 開始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 制備方法 | 具體內容 |
| 干法 | Fe2O3、KNO3、KOH混合加熱共熔生成紫紅色高鐵酸鉀和KNO2等產物 |
| 濕法 | 強堿性介質中,Fe(NO3)3與KClO反應生成紫紅色高鐵酸鉀溶液 |
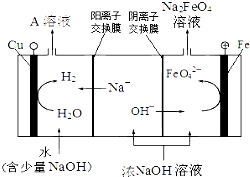
| 電解法 | 電解濃NaOH溶液制備Na2FeO4 |
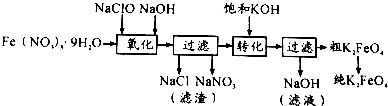
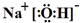 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 由軟錳礦制備高錳酸鉀的主要反應如下:
由軟錳礦制備高錳酸鉀的主要反應如下:| K2CO3 | KHCO3 | K2SO4 | KMnO4 | |
| 溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com