
【題目】一定條件下進行反應:COCl2(g)![]() Cl2 (g)+CO(g)。向2.0 L恒容密閉容器中充入1.0 mol COCl2 (g),經過一段時間后達到平衡。反應過程中測得的有關數據見下表:
Cl2 (g)+CO(g)。向2.0 L恒容密閉容器中充入1.0 mol COCl2 (g),經過一段時間后達到平衡。反應過程中測得的有關數據見下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2) /mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列說法正確的是 ( )
A.保持其他條件不變,升高溫度,平衡時c(Cl2) = 0.22 mol·L-1,則反應的 △H < 0
B.若在2 L恒容絕熱(與外界沒有熱量變換)密閉容器進行該反應,化學平衡常數不變
C.保持其他條件不變,起始向容器中充入1.2 mol COCl2、0.60 mol Cl2和0.6 mol CO,反應達到平衡前的速率:v (正) > v (逆)
D.保持其他條件不變,起始向容器中充入1.0 mol Cl2和0.8 mol CO,達到平衡時,Cl2的轉化率小于60%
【答案】D
【解析】
由表中數據可知,6s、8s時氯氣的物質的量都是0.4mol,說明6s時反應到達平衡,平衡時氯氣的濃度為0.2mol/L。
A. 由表中數據可知,6s、8s時氯氣的物質的量都是0.4mol,說明6s時反應到達平衡,平衡時氯氣的濃度為0.2mol/L,升高溫度,到達新平衡,氯氣的濃度變為0.22mol/L,氯氣濃度增大,說明平衡向正反應方向移動,故正反應為吸熱反應,即△H>0,故A錯誤;
B. 正反應為吸熱反應,恒容絕熱密閉容器進行該反應,隨反應進行溫度降低,而平衡常數只受溫度影響,故平衡常數一定發生變化,故B錯誤;
C. 平衡時![]() ,列三段式:
,列三段式: ,該溫度下平衡常數
,該溫度下平衡常數![]() ,若起始向容器中充入1.2mol
,若起始向容器中充入1.2mol![]() 、0.60mol
、0.60mol![]() 和0.60mol
和0.60mol![]() ,此時
,此時![]() >0.13,則反應向逆反應方向移動,反應達到平衡前v正<v逆,故C錯誤;
>0.13,則反應向逆反應方向移動,反應達到平衡前v正<v逆,故C錯誤;
D. 原平衡等效為起始向容器中充入1.0mol![]() 和1.0mol
和1.0mol![]() ,達到平衡時
,達到平衡時![]() 的轉化率
的轉化率![]() ,如加入1.0mol
,如加入1.0mol![]() 和0.8mol
和0.8mol![]() ,相當于在原來的基礎上減小0.2molCO,平衡在原來的基礎上向正反應方向移動,則
,相當于在原來的基礎上減小0.2molCO,平衡在原來的基礎上向正反應方向移動,則![]() 的轉化率減小,則
的轉化率減小,則![]() 的轉化率小于60%,故D正確。
的轉化率小于60%,故D正確。
答案選D。


科目:高中化學 來源: 題型:
【題目】25℃時,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一組醋酸、醋酸鈉混合溶液,溶液中c(CH3COOH)、c(CH3COO-)與pH的關系如圖所示。下列有關溶液中離子濃度關系的敘述不正確的是( )
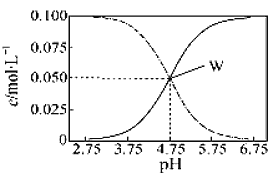
A.pH=5.5的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
B.W點所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
C.pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向W點所表示的1.0L溶液中通入0.05molHCl氣體(忽略溶液體積變化):c(H+)=c(CH3COOH)+c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉻是一種銀白色的堅硬金屬,鉻的工業用途很廣,主要有金屬加工、電鍍、制革行業,這些行業排放的廢水和廢氣是環境中的主要污染源。請回答下面與鉻有關的一些問題。
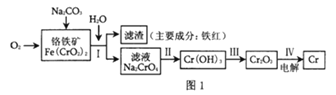
(1)工業上冶煉鉻的主要步驟如圖1所示:
①已知步驟Ⅱ的反應方程式為:8Na2CrO4+6Na2S+23H2O=8Cr(OH)3↓+3Na2S2O3+22NaOH。該反應中氧化劑是___(填化學式),生成1molCr(OH)3時轉移電子的物質的量為___mol;
②步驟IV中電解Cr2O3的陽極反應式為___;
(2)某工廠采用電解法處理含鉻廢水,耐酸電解槽用鐵板作陰、陽極,槽中盛放含鉻廢水,原理示意圖如圖2,A為電源的___(填“正極”“負極”),陽極區溶液中發生的氧化還原反應為___。
(3)化學需氧量(COD)可量度水體受有機物污染的程度。它是在強酸并加熱條件下,用K2Cr2O7作強氧化劑處理水樣時所消耗的K2Cr2O7的量,換算成相當于O2的含量(以mg/L計)。某研究性學習小組測定某水樣的化學需氧量(COD),過程如下:
Ⅰ.取VamL水樣于錐形瓶,加入10.00mL0.2500mol/L K2Cr2O7溶液;
Ⅱ.加碎瓷片少許,然后慢慢加入少量硫酸,混合均勻,加熱;
Ⅲ.反應完畢后,冷卻,加指示劑,用cmol/L的硫酸亞鐵銨(NH4)2Fe(SO4)2溶液滴定。終點時消耗硫酸亞鐵銨溶液VbmL(此步操作的目的是用Fe2+把多余的Cr2O72-反應成Cr3+)。
①Ⅰ中,量取K2Cr2O7溶液的儀器是___;
②Ⅱ中,碎瓷片的作用是___;
③該水樣的化學需氧量COD=___(用含c、Va、Vb的表達式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨工業、硫酸工業的生產工藝流程大致為:

合成塔和接觸室中的反應分別為:N2(g)+3H2(g)![]() 2NH3(g) △H﹤0; 2SO2(g)+O2(g)
2NH3(g) △H﹤0; 2SO2(g)+O2(g)![]() 2SO3(g) △H﹤0
2SO3(g) △H﹤0
(1)寫出流程中設備的名稱:B____________,X___________。
(2)進入合成塔和接觸室中的氣體都要進行熱處理,最理想的熱處理方法是_________________。
(3)采用循環操作可提高原料的利用率,下列生產中,采用循環操作的是____________(填序號)。
①硫酸工業 ②合成氨工業 ③硝酸工業
(4)工業上常用98.3%的濃硫酸吸收SO3而不用稀硫酸或水的原因是_______________________。
(5)工業生產中常用氨——酸法進行尾氣脫硫,以達到消除污染、廢物利用的目的。硫酸工業尾氣中的SO2經處理可以得到一種化肥,該肥料的化學式是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】奈必洛爾是一種用于血管擴張的降血壓藥物,

已知:乙酸酐的結構簡式為![]() 。
。
請回答下列問題:
(1)B的分子式為______________,反應①的反應類型為________________
(2)C所含官能團的名稱為__________________________________________。
(3)反應⑤的化學方程式為_________________,該反應的反應類型是_________________。
(4)寫出滿足下列條件的E的同分異構體的結構簡式:___________、______________。
Ⅰ.苯環上只有三個取代基
Ⅱ.核磁共振氫譜圖中只有4組吸收峰
Ⅲ.1mol該物質與足量NaHCO3溶液反應生成2molCO2
(5)根據已有知識并結合相關信息,寫出以![]() 為原料制備
為原料制備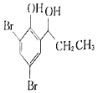 的合成路線流程圖(無機試劑任選)_____________。(合成路線流程圖示例如下:CH3CH2Br
的合成路線流程圖(無機試劑任選)_____________。(合成路線流程圖示例如下:CH3CH2Br![]() CH3CH2OHCH3COOCH2CH3)
CH3CH2OHCH3COOCH2CH3)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在三個容積均為2.0 L的恒容密閉容器中發生反應:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。各容器中起始物質的量濃度與反應溫度如下表所示:
N2(g)+2CO2(g)。各容器中起始物質的量濃度與反應溫度如下表所示:
容器 | 溫度/℃ | 起始物質的量濃度/(mol·L-1) | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T2 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
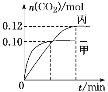
反應過程中甲、丙容器中CO2的物質的量隨時間變化關系如圖所示。下列說法正確的是
A.該反應的正反應為放熱反應,平衡常數K(T1)<K(T2)
B.乙容器中反應達到平衡時,N2的轉化率小于40%
C.達到平衡時,乙容器中的壓強一定大于甲容器的2倍
D.丙容器中反應達到平衡后,再充入0.10 mol NO和0.10 mol CO2,此時υ(正)<υ(逆)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定微粒的數目相等的是
A.等物質的量的12CO2與14CO2含有的中子數
B.同溫、同壓、同體積的CO2和N2O含有的質子數
C.等質量的己烷和丁烷中含有的共用電子對數
D.等物質的量的鈉和鐵分別與足量氯氣完全反應時轉移的電子數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】坦桑石是一種世界公認的新興寶石,這種寶石于1967年首次在赤道雪山腳下的阿魯沙地區被發現。坦桑石的主要化學成分為![]() ,還可含有V、Cr、Mn等元素。
,還可含有V、Cr、Mn等元素。
![]() 下列狀態的鋁中,電離最外層的一個電子所需能量最大的是________
下列狀態的鋁中,電離最外層的一個電子所需能量最大的是________![]() 填序號
填序號![]() 。
。
①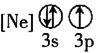 ②
②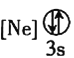 ③
③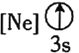 ④
④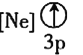
![]() 煙酸鉻是鉻的一種化合物,其合成過程如下:
煙酸鉻是鉻的一種化合物,其合成過程如下:
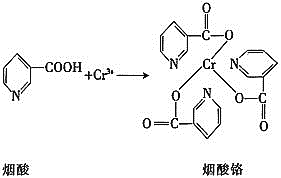
![]() 核外電子排布式為________。
核外電子排布式為________。
![]() 、C、N、O的電負性由大到小的順序是_________。
、C、N、O的電負性由大到小的順序是_________。
![]() 煙酸中碳、氮原子的雜化方式分別為________、________。
煙酸中碳、氮原子的雜化方式分別為________、________。
![]() 分子中的大
分子中的大![]() 鍵可用符號
鍵可用符號![]() 表示,其中m代表參與形成大
表示,其中m代表參與形成大![]() 鍵的原子數,n代表參與形成大
鍵的原子數,n代表參與形成大![]() 鍵的電子數
鍵的電子數![]() 如二氧化碳分子中的大
如二氧化碳分子中的大![]() 鍵可表示為
鍵可表示為![]() ,則煙酸中的大
,則煙酸中的大![]() 鍵應表示為___________。
鍵應表示為___________。
![]() 、
、![]() 都極易水解。
都極易水解。![]() 、
、![]() 都屬于______
都屬于______![]() 填“極性”或“非極性”
填“極性”或“非極性”![]() 分子,其熔點的關系為
分子,其熔點的關系為![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 將Mn摻入GaAs晶體
將Mn摻入GaAs晶體![]() 圖甲
圖甲![]() 可得到稀磁性半導體材料
可得到稀磁性半導體材料![]() 圖乙
圖乙![]() ,圖甲、圖乙晶體結構不變。
,圖甲、圖乙晶體結構不變。
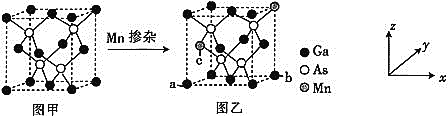
![]() 圖乙中a點和b點的原子坐標參數分別為
圖乙中a點和b點的原子坐標參數分別為![]() 0,
0,![]() 和
和![]() 1,
1,![]() ,則c點的原子坐標參數為________。
,則c點的原子坐標參數為________。
![]() 設圖甲晶體的密度為
設圖甲晶體的密度為![]() ,用
,用![]() 表示阿伏加德羅常數的數值,則該晶胞中距離最近的兩個鎵原子之間的距離為________________pm。
表示阿伏加德羅常數的數值,則該晶胞中距離最近的兩個鎵原子之間的距離為________________pm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水仙花所含的揮發油中含有丁香油酚、苯甲醇、苯甲醛、桂皮醇等成分。它們的結構簡式如下:
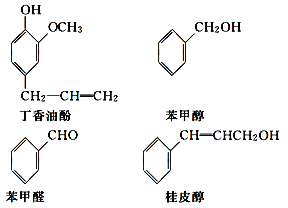
請回答下列問題:
(1)①丁香油酚中含氧的官能團是_____;丁香油酚可能具有的性質是_____(填字母)。
A.可與燒堿反應
B.只能與Br2發生加成反應
C.既可燃燒,也可使酸性KMnO4溶液褪色
D.可與NaHCO3溶液反應放出CO2氣體
②從結構上看,上述四種有機物中與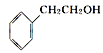 互為同系物的是____(填名稱)。
互為同系物的是____(填名稱)。
(2)苯甲醛經________(填反應類型)反應可得到苯甲醇。寫出苯甲醛和銀氨溶液反應化學方程式為___________________________________。III
(3)由桂皮醇轉化為丙的過程為(已略去無關產物)
桂皮醇![]()
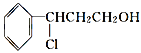
![]() 甲
甲![]() 乙
乙![]() 丙
丙
如果反應Ⅱ為消去反應,則反應Ⅱ的條件是_______________,反應Ⅲ為加聚反應,則高聚物丙的結構簡式為_________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com