
分析 (1)強堿滴定強酸,反應后呈中性,可用酚酞為指示劑,滴定終點,溶液顏色由無色變為淺紅色;
(2)氫氧化鈉溶液的體積為20.20mL-0.10mL=20.10mL,酸堿恰好完全反應,滿足c(酸)V(酸)=c(堿)V(堿),以此計算;
(3)裝標準氫氧化鈉溶液的滴定管用蒸餾水潤洗后,未用標準液潤洗,則標準液的濃度偏小.
解答 解:(1)強堿滴定強酸,反應后呈中性,可用酚酞為指示劑,滴定終點,溶液顏色由無色變為淺紅色,如滿足半分鐘不褪色,可說明達到滴定終點,
故答案為:酚酞;無;淺紅;半分鐘不褪色;
(2)氫氧化鈉溶液的體積為20.20mL-0.10mL=20.10mL,酸堿恰好完全反應,滿足c(酸)V(酸)=c(堿)V(堿),則該鹽酸的濃度為$\frac{20.12×0.1212}{20.00}$mol/L=0.1218mol/L,
故答案為:20.10;0.1218;
(3)裝標準氫氧化鈉溶液的滴定管用蒸餾水潤洗后,未用標準液潤洗,則標準液的濃度偏小,所用標準液的體積偏大,則測定濃度偏大,
故答案為:偏大.
點評 本題考查中和滴定,為高頻考點,把握中和滴定操作及誤差分析為解答的關鍵,側重分析與應用能力的考查,注意誤差分析為解答的難點,題目難度不大.


 黃岡創優卷系列答案
黃岡創優卷系列答案科目:高中化學 來源: 題型:解答題
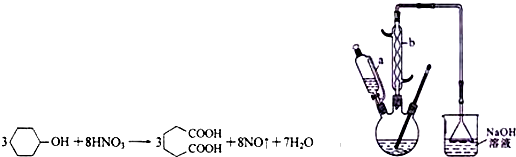
| 物質 | 密度(20℃) | 熔點 | 沸點 | 溶解性 |
| 環己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃時水中溶解度為3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃時1.44g,25℃時2.3g,易溶于乙醇、不溶于苯 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
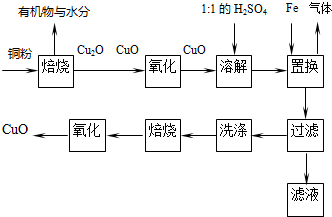
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 苯乙酸銅是合成優良催化劑、傳感材料--納米氧化銅的重要前驅之一.下面是它的一種實驗室合成路線:
苯乙酸銅是合成優良催化劑、傳感材料--納米氧化銅的重要前驅之一.下面是它的一種實驗室合成路線: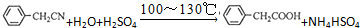

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
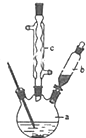
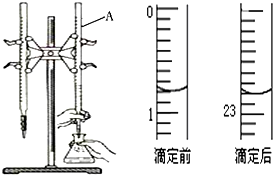 圖是用0.1000mol/L的鹽酸滴定某未知濃度的NaOH溶液的示意圖和某次滴定前、后的盛放鹽酸滴定管中液面的位置.請回答:
圖是用0.1000mol/L的鹽酸滴定某未知濃度的NaOH溶液的示意圖和某次滴定前、后的盛放鹽酸滴定管中液面的位置.請回答:| 實驗 編號 | 待測NaOH溶液的體積(mL) | 滴定前鹽酸的 體積讀數(mL) | 滴定后鹽酸的 體積讀數(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 某學生為測定未知濃度的硫酸溶液,進行如下實驗:用1.00mL待測硫酸溶液配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定終止時消耗NaOH溶液15.00mL.
某學生為測定未知濃度的硫酸溶液,進行如下實驗:用1.00mL待測硫酸溶液配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定終止時消耗NaOH溶液15.00mL.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗編號 | 鹽酸的體積(mL) | 標準NaOH溶液的體積(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在該條件下,反應前后的壓強之比為6:5.3 | |
| B. | 若反應開始時容器體積為2 L,則0~2 min內v(SO3)=0.35 mol/(L•min) | |
| C. | 在該條件下充入He氣,各物質的反應速率都將增大 | |
| D. | 若反應改為“恒溫恒容下”進行,放出Q kJ熱量需要的時間將大于2 min |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com