
| 實驗編號 | 鹽酸的體積(mL) | 標準NaOH溶液的體積(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
分析 (1)根據實驗具體操作步驟有:計算、稱量、溶解、冷卻、移液、洗滌移液、定容、搖勻等,來選擇實驗所需儀器;
(2)根據c(酸)=$\frac{c堿×V堿}{V酸}$,判斷不當操作對相關物理量的影響;
(3)根據c(酸)=$\frac{c堿×V堿}{V酸}$計算.
解答 解:(1)一定規格的容量瓶只能配制相應體積的溶液,容量瓶應選擇250ml規格;一般用托盤天平稱量,用藥匙取用藥品,在燒杯中溶解(可用量筒量取水),用玻璃棒攪拌,冷卻后轉移到250mL容量瓶中,并用玻璃棒引流,洗滌并將洗滌液移入容量瓶中,當加水至液面距離刻度線1~2cm時,改用膠頭滴管滴加至溶液凹面與刻度線水平相切,蓋好瓶塞,搖勻.所以需要的儀器為:托盤天平、藥匙、燒杯、筒量(可用、也可不用)、玻璃棒、250ml容量瓶、膠頭滴管,
故答案為:燒杯、玻璃棒、250ml容量瓶、膠頭滴管;
(2)對比表中數據,誤差較大的是第1次實驗,需要標準液的體積偏大,由c(酸)×V(酸)=c(堿)×V(堿)判斷:
a.在裝未知濃度鹽酸前錐形瓶里面有少量水,未烘干,無影響,故錯誤;
b.堿式滴定管在裝液前未用標準NaOH溶液潤洗2~3次,標準液濃度偏小,則體積偏大,故正確;
c.滴定開始前堿式滴定管尖嘴部分有氣泡,在滴定終點讀數時未發現氣泡,會導致讀數偏大,故正確;
d.滴定開始前堿式滴定管尖嘴部分沒有氣泡,在滴定終點讀數時發現尖嘴部分有氣泡,會導致體積偏小,故錯誤;
e.滴定過程中,錐形瓶搖蕩得太劇烈,以致有些液滴飛濺出來,導致需要標準液體積偏小,故錯誤;
f.達到滴定終點時,俯視溶液凹液面最低點讀數,會導致讀數偏小,故錯誤;
g.滴定到終點時,溶液顏色由無色變到了紅色,導致需要標準液體積偏大,故正確;
故答案為:1;bcg;
(3)取2、3體積進行計算,所用標準液的平均體積為$\frac{17.10+16.90}{2}$mL=17.0mL,
則根據c(酸)=$\frac{c堿×V堿}{V酸}$=$\frac{0.5mol/L×17}{20}$=0.425mol/L,
故答案為:0.425mol/L.
點評 本題考查了中和滴定及誤差分析,要求選擇掌握中和滴定的操作方法及完成分析的方法,試題基礎性強,貼近高考;該題難易適中,注重靈活性,側重對學生能力的培養和解題方法的指導和訓練,有利于培養學生的邏輯思維能力和嚴謹的規范實驗操作能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
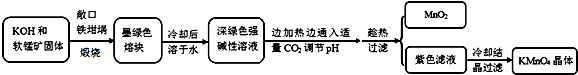
| 物質 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
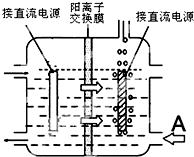
科目:高中化學 來源: 題型:實驗題
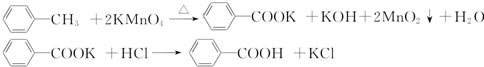
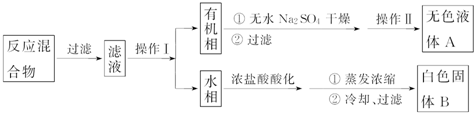
| 序號 | 實驗方案 | 實驗現象 | 結論 |
| ① | 將白色固體B加入水中,加熱溶解,冷卻結晶,過濾 | 得到白色晶體和無色濾液 | |
| ② | 取少量濾液于試管中,滴入稀HNO3酸化的AgNO3溶液 | 生成白色沉淀 | 濾液含Cl- |
| ③ | 干燥白色晶體,取適量加熱,測定熔點 | 白色晶體在122.4℃熔化為液體 | 白色晶體是苯甲酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
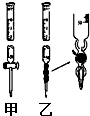 Ⅰ.(1)某學習小組用0.80mol/L標準濃度的氫氧化鈉溶液測定未知濃度的鹽酸.
Ⅰ.(1)某學習小組用0.80mol/L標準濃度的氫氧化鈉溶液測定未知濃度的鹽酸.| 實驗編號 | 待測鹽酸溶液的體積/mL | 滴入NaOH溶液的體積/mL |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
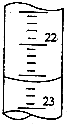 用中和滴定法測定燒堿的純度,若燒堿中不含有與酸反應的雜質,試根據實驗回答:
用中和滴定法測定燒堿的純度,若燒堿中不含有與酸反應的雜質,試根據實驗回答:| 滴定次數 | 待測液體積/mL | 標準鹽酸體積/mL | |
| 滴定前讀數(mL) | 滴定后讀數(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間(s) | 0 | 1 | 2 | 3 | 4 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com