
| 成分 含量/% 階段 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 預處理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 預處理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
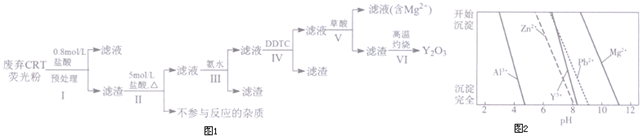
分析 廢棄CRT熒光粉的化學組成為Y2O3、ZnO、Al2O3、PbO2、MgO等,加鹽酸,過濾,濾渣主要含有Y2O3,還有少量的PbO2、ZnO、Al2O3、MgO,再加5mol/L的鹽酸,PbO2與HCl發生氧化還原反應,生成氯氣和PbCl2,Y2O3轉化為Y3+,過濾,濾液中含有Pb2+和Y3+、Al3+、Zn2+、Mg2+,再加氨水,Al3+形成Al(OH)3沉淀,過濾,濾液中含有Pb2+和Y3+、Zn2+、Mg2+,加DDTC除去溶液中的Pb2+和Zn2+,過濾,濾液中加草酸,生成Y2(C2O4)3沉淀,過濾,濾渣為Y2(C2O4)3固體,高溫灼燒Y2(C2O4)3生成Y2O3;
(1)進行原料預處理可以除去部分ZnO和Al2O3,富集稀土元素等;
(2)PbO2與HCl發生氧化還原反應,生成氯氣和PbCl2,根據原子守恒和得失電子守恒寫出方程式;
(3)步驟Ⅲ是用氨水除去溶液中的Al3+;
(4)根據流程分析;由圖2可知Zn2+、Pb2+與Y3+沉淀的pH相近;
(5)根據Ksp[Y2(C2O4)3]=c2(Y3+)×c3(C2O42-)計算;
(6)草酸釔隔絕空氣加熱可以得到Y2O3和CO、CO2.
解答 解:廢棄CRT熒光粉的化學組成為Y2O3、ZnO、Al2O3、PbO2、MgO等,加鹽酸,過濾,濾渣主要含有Y2O3,還有少量的PbO2、ZnO、Al2O3、MgO,再加5mol/L的鹽酸,PbO2與HCl發生氧化還原反應,生成氯氣和PbCl2,Y2O3轉化為Y3+,過濾,濾液中含有Pb2+和Y3+、Al3+、Zn2+、Mg2+,再加氨水,Al3+形成Al(OH)3沉淀,過濾,濾液中含有Pb2+和Y3+、Zn2+、Mg2+,加DDTC除去溶液中的Pb2+和Zn2+,過濾,濾液中加草酸,生成Y2(C2O4)3沉淀,過濾,濾渣為Y2(C2O4)3固體,高溫灼燒Y2(C2O4)3生成Y2O3;
(1)由表格數據可知:進行原料預處理可以除去部分ZnO和Al2O3,富集稀土元素;在后續操作中能降低耗酸量等,
故答案為:除去ZnO和Al2O3;富集稀土元素;降低后續耗酸量;
(2)PbO2與HCl發生氧化還原反應,生成氯氣和PbCl2,則反應的方程式為:PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O,
故答案為:PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;
(3)由流程分析可知,步驟Ⅲ是用氨水除去溶液中的Al3+,其反應的離子方程式為:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
故答案為:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(4)根據流程分析可知,步驟Ⅳ中除雜試劑DDTC除去的雜質離子有;由圖2可知Zn2+、Pb2+與Y3+沉淀的pH相近,三者因同時沉淀而無法分離,所以不能通過直接加堿的方法除去Zn2+、Pb2+;
故答案為:Zn2+、Pb2+;Zn2+、Pb2+與Y3+沉淀的pH相近,三者因同時沉淀而無法分離;
(5)已知:當離子濃度小于10-5mol/L時,沉淀就達完全,Ksp[Y2(C2O4)3]=c2(Y3+)×c3(C2O42-)=(10-5)2×c3(C2O42-)=8.0×10-28,則c(C2O42-)=$\root{3}{\frac{8.0×1{0}^{-28}}{(1{0}^{-5})^{2}}}$=2.0×10-6mol/L,故答案為:2.0×10-6;
(6)草酸釔隔絕空氣加熱可以得到Y2O3和CO、CO2,其反應的方程式為Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑,故答案為:Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑.
點評 本題考查了物質的分離提純實驗操作,題目涉及到氧化還原、出除雜質、溶度積常數的應用等,題目難度中等,注意根據題意寫出有關反應的方程式,做題時注意根據物質的性質正確判斷反應物和生成物,用守恒的方法去書寫.


科目:高中化學 來源: 題型:解答題
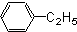 芳香烴,(7)
芳香烴,(7)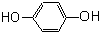 酚,(8)
酚,(8)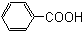 芳香酸.
芳香酸.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在0.1 mol•L-1FeCl3溶液中,Na+、NH4+、HCO3-、ClO-一定大量共存 | |
| B. | 常溫下,某溶液中由水電離出的c(H+)=1×10-amol•L-1,則該溶液一定pH=a | |
| C. | 相同物質的量濃度下列溶液:①NH4Al(SO4)2;②NH4Cl;③CH3COONH4;④NH3•H2O.其中c(NH4+)由大到小的順序是①>②>③>④ | |
| D. | AgCl懸濁液中存在如下平衡:AgCl(s)?Ag+(aq)+Cl-(aq).向其中加入少量NaCl晶體,平衡逆向移動,故AgCl溶解度減少,溶度積Ksp也減少 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
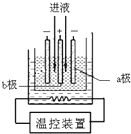 用軟錳礦(MnO2)、黃鐵礦(FeS2)酸浸生產硫酸錳(MnSO4),并進一步制取 電解二氧化錳(EMD)的工藝流程如下:
用軟錳礦(MnO2)、黃鐵礦(FeS2)酸浸生產硫酸錳(MnSO4),并進一步制取 電解二氧化錳(EMD)的工藝流程如下: Fe(OH)3+3H+,加入CaCO3后,由于CaCO3(s)
Fe(OH)3+3H+,加入CaCO3后,由于CaCO3(s) Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,使得Fe3+的水解平衡向正反應方向移動,Fe3+轉化為Fe(OH)3沉淀而被除去.
Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,使得Fe3+的水解平衡向正反應方向移動,Fe3+轉化為Fe(OH)3沉淀而被除去.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 兩個信號,強度之比為1:1 | B. | 三個信號,強度之比為3:2:1 | ||
| C. | 兩個信號,強度之比為3:1 | D. | 三個信號,強度之比為1:1:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 催化劑能夠改變反應的反應熱 | |
| B. | 催化劑能夠改變反應物的活化分子百分數 | |
| C. | 催化劑能改變反應物的轉化率 | |
| D. | 催化劑通過升高反應的活化能來加快反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 四種元素位于同一周期 | B. | b+1=d-1 | ||
| C. | 氫化物穩定性:H2Y>HZ | D. | 離子的氧化性:W3+>X+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com