
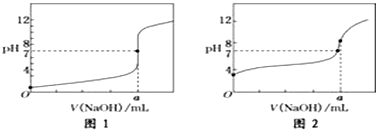
分析 (1)0.1mol•L-1的NaOH溶液中c(OH-)=0.1mol/L,根據Kw=c(H+)•c(OH-)計算溶液中c(H+),再根據pH=-lgc(H+)計算溶液的pH值;
(2)溶液中存在電離平衡,應存在弱電解質;
(3)酸或堿抑制水電離,含有弱根離子的鹽促進水電離;
(4)①乙酸為弱電解質,滴定終點時,溶液呈堿性;
②NaOH和乙酸恰好反應時,消耗20mlNaOH溶液,生成弱酸強堿鹽,溶液呈堿性.
解答 解:(1)0.1mol•L-1的NaOH溶液中c(OH-)=0.1mol/L,故溶液中c(H+)=$\frac{1×1{0}^{-14}}{0.1}$mol/L=10-13mol/L,故該溶液的pH=-lg10-13=13,故答案為:13;
(2)0.1mol•L-1的CH3COOH溶液中存在溶劑水、水為弱電解質,溶質乙酸為弱電解質,存在電離平衡為CH3COOH?CH3COO-+H+、H2O?OH-+H+,
故答案為:CH3COOH?CH3COO-+H+;H2O?OH-+H+;
(3)酸或堿抑制水電離,含有弱根離子的鹽促進水電離,乙酸是弱電解質,氫氧化鈉、氯化氫是強電解質,所以相同物質的量濃度的乙酸和鹽酸和氫氧化鈉,鹽酸中水電離出的氫氧根離子濃度小于醋酸,相同物質的量濃度的鹽酸和氫氧化鈉對水電離抑制程度相等,鹽酸中水電離出的氫氧根離子濃度等于氫氧化鈉溶液中水的電離,所以水電離出氫氧根離子濃度大小順序是:丙>甲=乙,
故答案為:丙>甲=乙;
(4)①醋酸為弱電解質,滴定過程中pH變化較鹽酸緩慢,滴定終點時溶液呈堿性,則滴定醋酸溶液的曲線是圖2,故答案為:圖2;
②滴定終點時n(CH3COOH)=n(NaOH),則a=20.00mL,反應生成了醋酸鈉,醋酸根離子發生水解,CH3COO-+H2O?CH3COOH+OH-,溶液顯示堿性pH>7,
故答案為:20.00.
點評 本題綜合考查酸堿混合的定性判斷及溶液pH的計算,題目難度中等,明確溶液酸堿性與溶液pH的關系結合圖象進行判斷是解答本題關鍵,試題培養了學生的分析、理解能力及靈活應用所學知識的能力.


科目:高中化學 來源: 題型:解答題
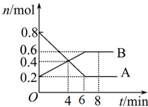 某溫度時,在2L密閉容器中某一反應的A、B物質的量隨時間變化的曲線如圖所示.
某溫度時,在2L密閉容器中某一反應的A、B物質的量隨時間變化的曲線如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| ①中物質 | ②中物質 | 實驗預測 | |
| A | 濃氨水 | 酚酞試液 | ②中溶液變為紅色 |
| B | 濃硝酸 | 淀粉KI溶液 | ②中溶液變為藍色 |
| C | 濃鹽酸 | 濃氨水 | 大燒杯中有白煙 |
| D | 飽和的亞硫酸溶液 | 稀溴水 | ②中無明顯變化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
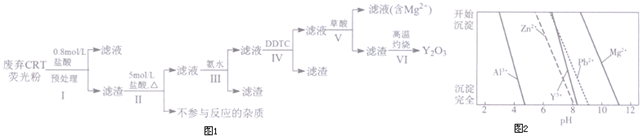
| 成分 含量/% 階段 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 預處理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 預處理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 裝置 |  |  |  |
| 現象 | 二價金屬A不斷溶解 | C的質量增加 | A上有氣體產生 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
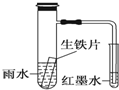
| A. | 生鐵片中的碳是原電池的負極,發生還原反應 | |
| B. | 雨水酸性較強,生鐵片始終發生析氫腐蝕 | |
| C. | 具支試管中溶液酸性增強 | |
| D. | 墨水回升時,碳電極反應式為O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{c(O{H}^{-})•c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$ | ||
| C. | c(H+)和c(OH-)的乘積 | D. | OH-的物質的量 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com