
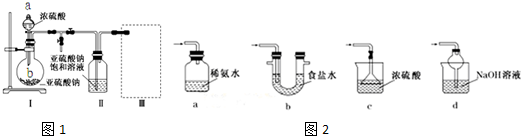
分析 (1)由裝置Ⅱ中發生的反應可知,裝置Ⅰ中產生的氣體為SO2,亞硫酸鈉與硫酸反應生成硫酸鈉、二氧化硫與水;
(2)裝置Ⅱ中獲得已析出的晶體,分離固體與液態,應采取過濾操作;
(3)裝置Ⅲ用于處理尾氣,吸收為反應的二氧化硫,應防止倒吸,且不能處于完全密閉環境中;
(4)NaHSO3溶液中HSO3-的電離程度大于水解程度,溶液呈酸性,故檢驗溶液呈酸性即可;
(5)Na2S2O5晶體在空氣中易被氧化為Na2SO4,用鹽酸、氯化鋇溶液檢驗樣品中是否含有硫酸根即可;
(6)①由消耗碘的量,結合SO2+I2+2H2O═H2SO4+2HI計算二氧化硫的質量,進而計算濃度;
②若有部分HI被空氣氧化,則消耗碘的量偏小,故測定二氧化硫的量偏小.
解答 解:(1)該儀器名稱是分液漏斗;由裝置Ⅱ中發生的反應可知,裝置Ⅰ中產生的氣體為SO2,亞硫酸鈉與硫酸反應生成硫酸鈉、二氧化硫與水,反應方程式為:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案為:分液漏斗;Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)裝置Ⅱ中獲得已析出的晶體,分離固體與液態,應采取過濾進行分離,使用的儀器是玻璃棒、漏斗、燒杯;
故答案為:玻璃棒、漏斗、燒杯;
(3)a.裝置應將導管深入氨水中可以吸收二氧化硫,但為密閉環境,裝置內壓強增大易產生安全事故,故錯誤;
b.該裝置吸收二氧化硫能力較差,且為密閉環境,裝置內壓強增大易產生安全事故,故錯誤;
c.該裝置不能吸收二氧化硫,所以無法實現實驗目的,故錯誤;
d.該裝置中氫氧化鈉與二氧化硫反應,可以吸收,且防止倒吸,故正確;
故答案為:d;
(4)NaHSO3溶液中HSO3-的電離程度大于水解程度,溶液呈酸性,測定溶液的pH,可以確定溶液酸堿性,酸性溶液可以使濕潤藍色石蕊試紙變紅,所以能用測定溶液pH值、濕潤的藍色石蕊試液檢驗,而加入Ba(OH)2溶液、HCl溶液、品紅溶液都不能說明溶液呈酸性,故選ae;
故答案為:ae;
(5)Na2S2O5中S元素的化合價為+4價,因此會被氧化為為+6價,即晶體在空氣中易被氧化為Na2SO4,用鹽酸、氯化鋇溶液檢驗樣品中是否含有硫酸根即可,實驗方案為:取少量Na2S2O5晶體于試管中,加入適量水溶解,滴加鹽酸,振蕩,再滴加氯化鋇溶液,有白色沉淀生成,
故答案為:取少量Na2S2O5晶體于試管中,加入適量水溶解,滴加鹽酸,振蕩,再滴加氯化鋇溶液,有白色沉淀生成;
(6)①令100mL葡萄酒中二氧化硫的質量為mg,則:
SO2+2H2O+I2═H2SO4+2HI
64g 1mol
mg 0.025L×0.01mol/L
所以,64g:mg=1mol:0.025L×0.01mol/L,
解得m=0.016
故該次實驗測得樣品中抗氧化劑的殘留量(以游離SO2計算)為$\frac{0.016g}{0.1L}$=0.16 g/L
故答案為:0.16;
②若有部分HI被空氣氧化,則消耗碘的量偏小,故測定二氧化硫的量偏小,則測定結果偏低,
故答案為:偏低.
點評 本題考查物質的制備實驗、實驗方案設計、物質含量的測定、氧化還原反應滴定等,難度中等,明確實驗原理是解本題關鍵,根據物質的性質分析解答,難點是(6)題計算,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 制取氯乙烷(CH3一CH2Cl)的最好的方法是乙烷與氯氣發生取代反應 | |
| B. | 乙烯、苯都能使溴水褪色,兩者的褪色原理相同 | |
| C. | 2-丁烯不存在順反異構體 | |
| D. | 研究有機物一般要經過的基本步驟為:分離、提純→元素定量分析(確定實驗式)→測定相對分子質量(確定分子式)→波譜分析(確定結構式),其中最早提出元素定量分析的是法國化學家李比希 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 上述反應既屬于氧化還原反應,又屬于離子反應 | |
| B. | 生成1 mol Cl2轉移電子數均為2NA | |
| C. | 鹽酸濃度越大,Cl-的還原性越強 | |
| D. | 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2 | B. | 3 | C. | 4 | D. | 6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
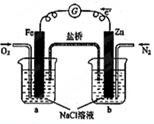
| A. | 向燒杯a中加入少量K3[Fe(CN)6]溶液,沒有藍色沉淀生成 | |
| B. | 燒杯b中發生反應為Zn+2e-=Zn2+ | |
| C. | 電子從Zn極流出,流入Fe極,經鹽橋回到Zn極 | |
| D. | 燒杯a中發生反應O2+4H++4e-=2H2O,溶液pH降低 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 PM2.5污染與直接排放化石燃燒產生的煙氣有關,化石燃料燃燒同時放出大量的SO2和NOx.
PM2.5污染與直接排放化石燃燒產生的煙氣有關,化石燃料燃燒同時放出大量的SO2和NOx.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 溶液中水電離出的c(H+)=10-10 mol•L-1 | |
| B. | 溶液中c(H+)+c(A-)=0.1 mol•L-1 | |
| C. | 與0.05 mol•L-1 NaOH溶液等體積混合,水的電離平衡向正向移動 | |
| D. | 上述溶液中加入一定量NaA晶體或加水稀釋,溶液的c(OH-)均增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Zn+2HCl═ZnCl2+H2↑ | B. | O2+4HCl═2Cl2+2H2O | ||
| C. | MnO2+4HCl(濃)═MnCl2+Cl2↑+2H2O | D. | 2HCl═Cl2+H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
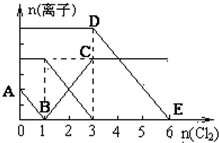 已知:2Fe3++2I-═2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入適量氯氣,溶液中各種離子的物質的量變化如圖所示.橫、縱坐標的單位均為mol.有關說法不正確的是( )
已知:2Fe3++2I-═2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入適量氯氣,溶液中各種離子的物質的量變化如圖所示.橫、縱坐標的單位均為mol.有關說法不正確的是( )| A. | 線段BC代表Fe3+物質的量的變化情況 | |
| B. | 原混合溶液中c(FeBr2)=6 mol/L | |
| C. | 原溶液中n (Fe2+):n (I-):n(Br-)=2:1:3 | |
| D. | 當通入Cl22mol時,溶液中已發生的反應可表示為2Fe2++2I━+2Cl2═2Fe3++I2+4Cl━ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com