
 PM2.5污染與直接排放化石燃燒產生的煙氣有關,化石燃料燃燒同時放出大量的SO2和NOx.
PM2.5污染與直接排放化石燃燒產生的煙氣有關,化石燃料燃燒同時放出大量的SO2和NOx.分析 (1)對已知熱化學方程式編號,依據已知的熱化學方程式利用蓋斯定律構造CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),然后根據關系式得到平衡常數的關系;
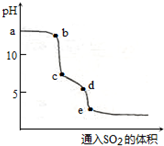
(2)向20mL0.1mol•L-1NaOH溶液通入SO2過程中首先發生SO2+2OH-=SO32-+H2O,其次發生SO2+SO32-+H2O=2HSO3-,據此分析.
解答 解:(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
由蓋斯定律$\frac{1}{2}×$(①+②)得到CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1,
如果三個反應的平衡常數依次為K1、K2、K3,則K3=(K1•K2)1/2;
故答案為:-867kJ•mol-1;K3=(K1•K2)1/2;
(2)向20mL0.1mol•L-1NaOH溶液通入SO2過程中首先發生SO2+2OH-=SO32-+H2O,其次發生SO2+SO32-+H2O=2HSO3-;所以ab段發生反應的離子方程式為SO2+2OH-=SO32-+H2O,
故答案為:SO2+2OH-=SO32-+H2O.
點評 本題考查了反應熱的計算和離子方程式的書寫,掌握蓋斯定律和無機物的化學性質是解題的關鍵,難度中等,注意化學平衡常數與化學方程式的數學關系.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
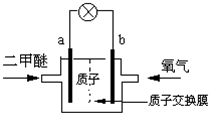 新能源開發中的燃料電池是低碳研究的重要領域.
新能源開發中的燃料電池是低碳研究的重要領域.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 有一未知的無色溶液,可能含有以下離子中的若干種(忽略由水電離產生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,現取兩份100mL溶液進行如下實驗:
有一未知的無色溶液,可能含有以下離子中的若干種(忽略由水電離產生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,現取兩份100mL溶液進行如下實驗:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 強電解質在水溶液中的電離過程是不可逆的 | |
| B. | 強電解質的水溶液導電能力一定比弱電解質的水溶液導電能力強 | |
| C. | 易溶于水的電解質一定是強電解質 | |
| D. | 同一弱電解質溶液,溫度不同時,導電能力相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使甲基橙呈紅色的溶液:Na+、NH4+、AlO2-、CO32- | |
| B. | 8%H2O2溶液:H+、Fe2+、SO42-、Cl- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | C(OH-)=0.1mol•L-1的溶液:Na+、K+、CO32-、ClO- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com