
 氧元素和鹵族元素都能形成多種物質,我們可以利用所學物質結構與性質的相關知識去認識和理解.
氧元素和鹵族元素都能形成多種物質,我們可以利用所學物質結構與性質的相關知識去認識和理解.| 氟 | 氯 | 溴 | 碘 | |
(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
分析 (1)COCl2中C原子的價電子對數為$\frac{4+2}{2}$=3,C原子采取sp2雜化,中心原子無孤電子對,C與O原子之間形成C=O雙鍵,其結構式是 ,據此判斷分子空間構型,溴是35號元素,最外層電子為其價電子,4s能級上排列2個電子,4p能級上排列5個電子,據此寫出價電子排布式;
,據此判斷分子空間構型,溴是35號元素,最外層電子為其價電子,4s能級上排列2個電子,4p能級上排列5個電子,據此寫出價電子排布式;
(2)在離子晶體中離子半徑越小,晶格能越大,據此判斷;
(3)第一電離能是指原子失去一個電子所需的能量,第一電離能越小,就越容易失去一個電子,據此答題;
(4)A. HCl中存在s-pσ鍵,B.HF中存在s-pσ鍵,C. SO2中存在p-pπ鍵,D. SCl2中存在p-pσ鍵,據此答題;
(5)根據中心原子的價層電子對數確定其雜化方式;等電子體是具有相同的價電子數和相同原子數的微粒;
(6)根據均攤法確定晶胞中各種原子的個數,再確定其化學式,根據密度確定晶胞的體積,進而求得晶胞的邊長,兩個離得最近的鈣是位于頂點和面心上的,它們的距離為晶胞邊長的$\frac{\sqrt{2}}{2}$,據此答題.
解答 解:(1)COCl2中C原子的價電子對數為$\frac{4+2}{2}$=3,C原子采取sp2雜化,中心原子無孤電子對,C與O原子之間形成C=O雙鍵,其結構式是 ,所以它的空間構型為平面三角形,溴是35號元素,最外層電子為其價電子,4s能級上排列2個電子,4p能級上排列5個電子,其價電子排布式為4s24p5,
,所以它的空間構型為平面三角形,溴是35號元素,最外層電子為其價電子,4s能級上排列2個電子,4p能級上排列5個電子,其價電子排布式為4s24p5,
故答案為:平面三角形;4s24p5;
(2)在離子晶體中離子半徑越小,晶格能越大,比較兩個反應的產物可知,由于氯離子的半徑小于碘離子,所以CsCl的晶格能大于CsI的晶格能,故答案選A;
(3)第一電離能是指原子失去一個電子所需的能量,第一電離能越小,就越容易失去一個電子,比較表格中的數據可知,碘更容易形成較穩定的單核陽離子,故答案為:碘;
(4)A. HCl中存在s-pσ鍵,B.HF中存在s-pσ鍵,C. SO2中存在p-pπ鍵,D. SCl2中存在p-pσ鍵,
故答案為:D;
(5)因為氯原子周圍有四對價層電子,所以中心原子的雜化方式為sp3雜化;CN-中有兩個原子,價電子數為10個,根據等電子體是具有相同的價電子數和相同原子數的微粒可知,它的等電子體分子是N2或 CO,
故答案為:sp3雜化;N2或 CO;
(6)根據均攤法可知晶胞中鈣離子的個數為8×$\frac{1}{8}+6×\frac{1}{2}$=4,過氧離子的個數為12×$\frac{1}{4}+1$=4,故其化學式為CaO2,設晶胞的邊長為a,根據$ρ=\frac{\frac{4×(40+32)}{{N}_{A}}}{{a}^{3}}$,得a=$\root{3}{\frac{72×4}{ρ{N}_{A}}}$cm,兩個離得最近的鈣是位于頂點和面心上的,它們的距離為晶胞邊長的$\frac{\sqrt{2}}{2}$倍,即為$\frac{\sqrt{2}}{2}×\root{3}{\frac{72×4}{ρ{N}_{A}}}$cm,
故答案為:CaO2;$\frac{\sqrt{2}}{2}×\root{3}{\frac{72×4}{ρ{N}_{A}}}$.
點評 本題主要考查原子核外電子排布、晶格能、原子雜化軌道、晶胞的計算等知識點,中等難度,解題時注意基礎知識的靈活運用.


 培優三好生系列答案
培優三好生系列答案 優化作業上海科技文獻出版社系列答案
優化作業上海科技文獻出版社系列答案科目:高中化學 來源: 題型:填空題
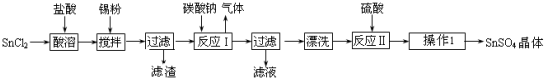
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | NH4+可能存在 | |
| B. | 若焰色反應測得K+存在,則NH4+不一定存在 | |
| C. | Cl-不可能存在 | |
| D. | Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | CCTV-8法蘭琳卡護膚產品廣告中“我們恨化學”嚴重違反科學,因其工藝肯定與化學有關 | |
| B. | 智能手機中使用的石墨烯不僅是電和熱的良導體,還是硬度較大的新型有機合成材料 | |
| C. | 采用催化轉換技術將汽車尾氣中的NOx和CO轉化為無毒氣體 | |
| D. | 為了能增加水中氧氣的含量,養金魚用的自來水一般先在陽光下曬一段時間 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入少量的NaOH固體,Na2S溶液中的c(Na+)、c(S2-)均增大 | |
| B. | Na2S溶液中存在著:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | Na2S溶液中離子濃度關系為:c(Na+)>c(OH-)>c(S2-)>c(H+) | |
| D. | Na2S溶液中存在著:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| X | ||
| Y | Z | W |
| T |
| A. | X、Z、W元素的原子半徑以及它們的氣態氫化物的熱穩定性均依次遞增 | |
| B. | YX2晶體熔化、液態WX3氣化均需克服分子間作用力 | |
| C. | 根據元素周期律,可以推測T元素的單質具有半導體特性,T2X3具有氧化性和還原性 | |
| D. | Y、Z、W元素在自然界中均不能以游離態存在,它們的最高價氧化物的水化物的酸性依次遞增 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
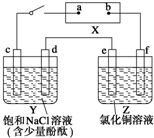 如圖中X是直流電源.Y槽中c、d為石墨棒,Z槽中e、f是質量相同的銅棒.接通電路后,發現d附近顯紅色.
如圖中X是直流電源.Y槽中c、d為石墨棒,Z槽中e、f是質量相同的銅棒.接通電路后,發現d附近顯紅色.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應2Mg+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+C△H<0從熵變角度看,可自發進行 | |
| B. | 在密閉容器發生可逆反應:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-113.0 kJ/mol,達到平衡后,保持溫度不變,縮小容器體積,重新達到平衡后,△H變小 | |
| C. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,將等體積濃度為1.0×10-4mol/L的AgNO3溶液滴入到濃度均為1.0×10-4mol/L的KCl和K2CrO4的混合溶液中產生兩種不同沉淀,且Ag2CrO4沉淀先產生 | |
| D. | 根據HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推測相同狀況下,等濃度的NaClO與Na2CO3溶液中,pH前者小于后者 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com