
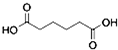
 是一種工業上具有重要意義的有機二元酸,在化工生產、有機合成工業、醫藥、潤滑劑制造等方面都有重要作用,能夠發生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位.實驗室合成己二酸的反應原理和實驗裝置示意圖如圖:
是一種工業上具有重要意義的有機二元酸,在化工生產、有機合成工業、醫藥、潤滑劑制造等方面都有重要作用,能夠發生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位.實驗室合成己二酸的反應原理和實驗裝置示意圖如圖: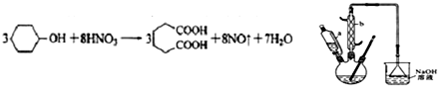
| 物質 | 密度(20℃) | 熔點 | 沸點 | 溶解性 | 相對分子質量 |
| 環己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃時水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃時,1.44g,25℃時2.3g,易溶于乙醇,不溶于苯 | 146 |
分析 (1)依據儀器的構造可知:儀器a的名稱為:恒壓滴液漏斗;
(2)環己醇的滴入速率過快,反應過快,該反應放熱,反應溫度高,反應液暴沸沖出冷凝管;可能引起爆炸;產生的二氧化氮氣體來不及被堿液吸收而外逸到空氣中;
(3)根據元素守恒,純堿與NO和NO2反應,生成NaNO2、NaNO3,且放出CO2,據此寫反應的化學方程式;
(4)產品己二酸中含有環己醇、硝酸等雜質,根據己二酸在水中的溶解度:15℃時1.44g,25℃時2.3g,易溶于乙醇、不溶于苯分析;
(5)粗產品依據溶解度差別,可以通過重結晶可以提純;依據反應的環己醇為5.4mL,質量=5.4ml×0.962g/ml=5.1948g,結合化學方程式計算理論上上城己二酸的質量,產率=$\frac{實際量}{理論量}$×100%.
解答 解:(1)依據儀器的構造可知:儀器a的名稱為:恒壓滴液漏斗,
故答案為:恒壓滴液漏斗;
(2)向三口燒瓶中滴加環己醇時,反應溫度迅速上升,說明該反應為放熱反應,需控制好環己醇的滴入速率,如果環己醇的滴入速率過快,反應溫度高,反應液暴沸沖出冷凝管;可能引起爆炸;產生的二氧化氮氣體來不及被堿液吸收而外逸到空氣中,
故答案為:反應液暴沸沖出冷凝管,或放熱過多可能引起爆炸,或產生的二氧化氮氣體來不及被堿液吸收而外逸到空氣中;
(3)根據元素守恒,純堿與NO和NO2反應,生成NaNO2、NaNO3,且放出CO2,反應的化學方程式為①NO+NO2+Na2CO3═2NaNO2+CO2,②Na2CO3+2NO2═NaNO2+NaNO3+CO2,
故答案為:2NO2+Na2CO3═NaNO2+NaNO3+CO2,NO+NO2+Na2CO3═2NaNO2+CO2;
(4)產品己二酸中含有環己醇、硝酸等雜質,己二酸在水中的溶解度:15℃時1.44g,25℃時2.3g,溫度高溶解度大,可用冰水洗滌,除去環己醇、硝酸,己二酸不溶于苯,最后用苯洗滌晶體,除去表面的雜質,避免產品損失,
故答案為:苯;
(5)粗產品再溶解,再結晶析出,通過重結晶的方法提純己二酸,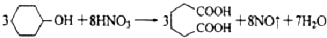
3×100 3×146
5.1948g m
m=7.58g
己二酸產率=$\frac{5.7g}{7.58g}$×100%=75%,
故答案為:重結晶;75%.
點評 本題考查實驗室合成己二酸,涉及儀器識別、物質的分離與提純、對操作的分析評價等,側重實驗分析能力及知識綜合應用能力的考查,題目難度中等.


 開心蛙口算題卡系列答案
開心蛙口算題卡系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | |||||||
| 3 | A | C | D | G | ||||
| 4 | B | F |
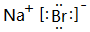 ,高溫灼燒該化合物時,火焰呈黃色.
,高溫灼燒該化合物時,火焰呈黃色.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
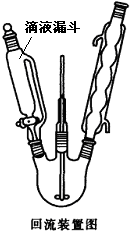 間硝基苯胺(Mr=128)是一種重要的染料中間體.它是一種黃色針狀結晶,微溶于水,隨溫度升高溶解度增大,溶于乙醇、乙醚、甲醇.間硝基苯胺可選用間二硝基苯與堿金屬多硫化物進行選擇性還原(裝置如右圖所示),其反應式如下:
間硝基苯胺(Mr=128)是一種重要的染料中間體.它是一種黃色針狀結晶,微溶于水,隨溫度升高溶解度增大,溶于乙醇、乙醚、甲醇.間硝基苯胺可選用間二硝基苯與堿金屬多硫化物進行選擇性還原(裝置如右圖所示),其反應式如下:
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. |  在新型催化劑作用下利用太陽能使水分解的能量變化曲線 | |
| B. |  KNO3溶解度曲線,α點所示溶液為50℃時的不飽和溶液 | |
| C. |  常溫下pH=2的HCl溶液加水稀釋倍數與pH的變化關系 | |
| D. |  10ml 0.01ml/L KMnO4酸性溶液與過量的0.1mol/L H2C2O4溶液混合時,n(Mn2+)隨時間的變化(Mn2+對該反應有催化作用) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.22 mol/L | B. | 0.11 mol/L | C. | 0.022 mol/L | D. | 0.011 mol/L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com