
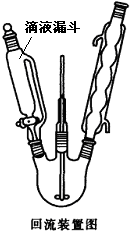
 間硝基苯胺(Mr=128)是一種重要的染料中間體.它是一種黃色針狀結晶,微溶于水,隨溫度升高溶解度增大,溶于乙醇、乙醚、甲醇.間硝基苯胺可選用間二硝基苯與堿金屬多硫化物進行選擇性還原(裝置如右圖所示),其反應式如下:
間硝基苯胺(Mr=128)是一種重要的染料中間體.它是一種黃色針狀結晶,微溶于水,隨溫度升高溶解度增大,溶于乙醇、乙醚、甲醇.間硝基苯胺可選用間二硝基苯與堿金屬多硫化物進行選擇性還原(裝置如右圖所示),其反應式如下:
分析 (1)配制一般溶液時用燒杯即可;
(2)濾餅洗滌三次,洗去表面的雜質,根據信息知間硝基苯胺微溶于水,隨溫度升高溶解度增大,溶于乙醇、乙醚、甲醇,所以選擇冷水洗滌,第⑥步產物要進行重結晶,需將粗產品溶解,用熱水,不能用有機物,不便于重結晶;
(3)蒸發過程中會析出溶解度隨溫度升高而降低(或影響不大)的物質,而間硝基苯胺隨溫度升高溶解度增大,第④步中趁熱過濾的目的是濾去雜質,防止目標產物遇冷析出,以免影響產量;
(4)有機分子去氧加氫為還原反應,根據題干信息鐵和鹽酸作用制得初生態氫原子(還原性遠強于堿金屬多硫化物),還原性強,不具有選擇性,未必能將硝基還原為氨基,得不到想要的產品;
(5)間硝基苯胺為有機物,微溶于水,第④步用鹽酸溶解粗產品,間硝基苯胺可與鹽酸作用可以形成鹽溶于水中;
(6)根據產率=$\frac{實際產品質量}{理論產品質量}$×100%計算.
解答 解:(1)配制一般溶液時用燒杯即可,
故答案為:燒杯;
(2)間硝基苯胺微溶于水,隨溫度升高溶解度增大,溶于乙醇、乙醚、甲醇,所以選擇冷水洗滌第③步中濾餅三次,二次結晶也就是重結晶,可提純晶體,間硝基苯胺溶于乙醇、乙醚、甲醇,不便于重結晶,用熱水,通過溫度調節,可用降溫結晶提純晶體,所以選擇熱水,
故答案為:A;B;
(3)蒸發過程中會析出溶解度隨溫度升高而降低(或影響不大)的物質,而間硝基苯胺隨溫度升高溶解度增大,第④步中趁熱過濾的目的是濾去雜質,防止目標產物遇冷析出,以免影響產量,
故答案為:濾去雜質,防止目標產物遇冷析出,以免影響產量;
(4)間硝基苯胺可選用間二硝基苯與堿金屬多硫化物進行選擇性還原,鐵和鹽酸作用制得初生態氫原子(還原性遠強于堿金屬多硫化物),還原性強,不具有選擇性,未必能將硝基還原為氨基,得不到想要的產品,所以不選,
故答案為:鐵和鹽酸作用還原性強,不具有選擇性;
(5)第④步用鹽酸溶解粗產品,是因為間硝基苯胺可與鹽酸作用可以形成鹽溶于水中,不用水的原因是間硝基苯胺微溶于水,
故答案為:間硝基苯胺微溶于水,但可與鹽酸作用可以形成鹽溶于水中;
(6)4.74g間二硝基苯(Mr=158)理論上轉化為間硝基苯胺的物質的量為$\frac{4.74g}{158g/mol}$,理論制得間硝基苯胺的質量為:$\frac{4.74g}{158g/mol}$×128g/mol=3.84g,產物重結晶提純,在紅外燈下干燥,稱重,得2.56g,產率=$\frac{實際產品質量}{理論產品質量}$×100%=$\frac{2.56g}{3.84g}$×100%≈66.7%,
故答案為:66.7%.
點評 本題考查間硝基苯胺制備實驗方案,涉及物質的分離提純、對裝置與操作的分析、化學計算等,明確原理是解題關鍵,需要學生具備扎實的基礎,有機化學實驗在中學中較少,學生較陌生,導致感覺解答問題較生疏,題目難度中等.


 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:解答題
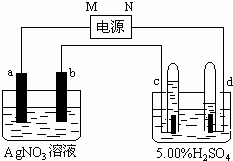 如圖中電極a、b分別為Ag電極和Pt電極,電極c、d都是石墨電極.通電一段時間后,在c、d兩極上共收集到336mL(標準狀態)氣體.請回答下列問題.
如圖中電極a、b分別為Ag電極和Pt電極,電極c、d都是石墨電極.通電一段時間后,在c、d兩極上共收集到336mL(標準狀態)氣體.請回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

| 物質 | 熔點/℃ | 沸點/℃ | 其他 |
| CCl4 | -23 | 76 | 與TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮濕空氣產生白霧 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
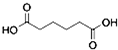 是一種工業上具有重要意義的有機二元酸,在化工生產、有機合成工業、醫藥、潤滑劑制造等方面都有重要作用,能夠發生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位.實驗室合成己二酸的反應原理和實驗裝置示意圖如圖:
是一種工業上具有重要意義的有機二元酸,在化工生產、有機合成工業、醫藥、潤滑劑制造等方面都有重要作用,能夠發生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位.實驗室合成己二酸的反應原理和實驗裝置示意圖如圖: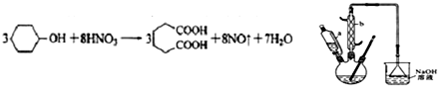
| 物質 | 密度(20℃) | 熔點 | 沸點 | 溶解性 | 相對分子質量 |
| 環己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃時水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃時,1.44g,25℃時2.3g,易溶于乙醇,不溶于苯 | 146 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 原子序數依次增大的四種主族元素A、B、C、D分別處于第一至第四周期,其中A原子核是一個質子;B原子核外電子有6種不同的運動狀態,B與C可形成正四面體型分子,D原子外圍電子排布為3d104s1.請回答下列問題:
原子序數依次增大的四種主族元素A、B、C、D分別處于第一至第四周期,其中A原子核是一個質子;B原子核外電子有6種不同的運動狀態,B與C可形成正四面體型分子,D原子外圍電子排布為3d104s1.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 生活垃圾焚燒處理后體積一般可減少40%~50% | |
| B. | 生活垃圾焚燒處理后體積一般可減少80%~90% | |
| C. | 因為是封閉式焚燒處理所以沒有煙氣排放 | |
| D. | 發出的電也有污染,不能用作生活用電 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在pH=1的溶液中:NH+4、K+、CH3COO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 有NO3-存在的強酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、S2-、AlO2-、SO32- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com