

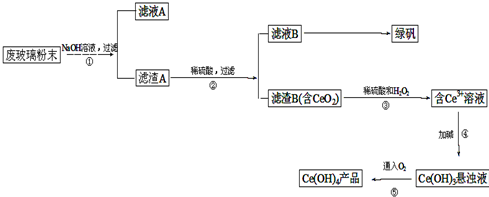
分析 鋁灰主要成分為Al、Al2O3、AlN、FeO等,加水發生反應,AlN發生水解生成氫氧化鋁和氨氣,加入鹽酸酸溶后,生成氯化鋁溶液和氯化亞鐵溶液,加入漂白劑氧化亞鐵離子為鐵離子,加入純堿調節溶液pH使鐵離子轉化為氫氧化鐵沉淀,采用噴霧干燥制備鋁鞣劑,
(1)AlN水解得到氣體M是氨氣,加熱可以促進氮化鋁水解生成氨氣,有利于氨氣的逸出;
(2)加入NaClO的作用是利用次氯酸根離子在酸溶液中的強氧化性,將氧化亞鐵離子為鐵離子;
(3)酸溶時使用的酸是鹽酸,氧化鋁溶于酸生成氯化鋁溶液;
(4)鋁鞣劑主要成分為Al(OH)2Cl,在加熱蒸發時會發生水解,為防止水解利用噴霧干燥,減少鋁鞣劑水解;
(5)常溫下Al的金屬性比Ba的金屬性弱,該反應是利用Ba的沸點比Al的低.
解答 解:鋁灰主要成分為Al、Al2O3、AlN、FeO等,加水發生反應,AlN發生水解生成氫氧化鋁和氨氣,加入鹽酸酸溶后,生成氯化鋁溶液和氯化亞鐵溶液,加入NaClO氧化亞鐵離子為鐵離子,加入純堿調節溶液pH使鐵離子轉化為氫氧化鐵沉淀,采用噴霧干燥制備鋁鞣劑.
(1)AlN水解得到氣體M是NH3,加熱可以加快AlN水解反應速率,降低NH3在水中的溶解度,促使NH3逸出,
故答案為:NH3;
(2)加入NaClO的作用是利用次氯酸根離子在酸溶液中的強氧化性,將氧化亞鐵離子為鐵離子,反應離子方程式為:2Fe2++2H++ClO-═2Fe3++Cl-+H2O,
故答案為:Fe2+;
(3)由流程圖可知,酸溶時使用的酸是鹽酸,氧化鋁溶解生成氯化鋁溶液,反應的離子方程式:Al2O3+6H+=2Al3++3H2O,
故答案為:Al2O3+6H+=2Al3++3H2O;
(4)鋁鞣劑主要成分為Al(OH)2Cl,在加熱蒸發時會發生水解,為防止水解利用噴霧干燥,減少鋁鞣劑水解,
故答案為:防止Al(OH)2Cl水解生成Al(OH)3;
(5)利用元素Ba、Al在元素周期表的位置可知金屬活潑性:Al<Ba;但Al在高溫下可將氧化鋇中鋇置換出來,原因是Ba的沸點低于鋁,高溫時Ba轉化為氣體脫離反應體系,使反應正向進行,
故答案為:弱;d.
點評 本題考查物質準備工藝流程,涉及對操作的分析評價、對條件控制分析、物質含量測定等,熟練掌握元素化合物知識,樹立資源回收再利用意識,是對學生綜合能力的考查.


科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaOH溶液不能用帶磨口玻璃塞的玻璃瓶盛放 | |
| B. | CO2與水反應生成碳酸,是酸性氧化物;SiO2不能與水反應生成硅酸,不是酸性氧化物 | |
| C. | 除去二氧化硅中少量的碳酸鈣雜質應選用水 | |
| D. | 粗硅制備時,發生的反應為C+SiO2═Si+CO2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
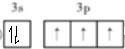 ,上述反應涉及的第二周期元素中第一電離能由大到小的順序為F>O>C(用元素符號表示).
,上述反應涉及的第二周期元素中第一電離能由大到小的順序為F>O>C(用元素符號表示).
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 石油里含有C5~C11的烷烴,可以通過石油的分餾得到汽油 | |
| B. | 含有C18以上的烷烴的重油經過催化裂化可以得到汽油 | |
| C. | 石油的分餾是一個物理過程,而裂化及裂解屬于化學過程 | |
| D. | 石油裂解的惟一目的是獲得乙烯 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 具有氧化性 | B. | 具有還原性 | C. | 具有漂白性 | D. | 含有極性鍵 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com