
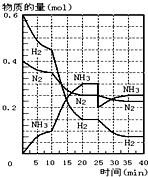
 (1)在一定條件下,將H2和N2置于一容積為2L的密閉容器中發生反應.反應過程中H2、N2和NH3的物質的量變化如圖:
(1)在一定條件下,將H2和N2置于一容積為2L的密閉容器中發生反應.反應過程中H2、N2和NH3的物質的量變化如圖:分析 ①根據v=$\frac{△c}{△t}$計算反應速率;
②由圖象可知各組分物質的量變化增快,且10min時是連續的,三種氣體物質的速率增加倍數相同,說明為使用催化劑;
③當反應達到化學平衡狀態時,正逆反應速率相等,各物質的濃度不再改變.
解答 解:①v(NH3)=$\frac{\frac{0.1mol}{2L}}{10min}$=0.005mol•L-1•min-1,故答案為:0.005mol•L-1•min-1;
②由圖可知,0-10分鐘內△n(N2)=0.025mol×2=0.05mol;10-20分鐘內△n′(N2)=0.025mol×4=0.1mol,速率之比等于物質的量之比,所以,0-10分鐘與10到20分鐘兩個時間段中,N2的反應速率之比為0.05mol:0.1mol=1:2;
由圖象可知各組分物質的量變化增快,且10min時變化是連續的,20min達平衡時,△n′(N2)=0.025mol×4=0.1mol,
△n(H2)=0.025mol×12=0.3mol,△n(NH3)=0.025mol×8=0.2mol,物質的量變化之比等于化學計量數之比,三種氣體物質的速率增加倍數相同,說明10min可能改變的條件是使用催化劑或升溫,
故答案為:使用了催化劑或升溫;
③a.N2和NH3濃度是否相等取決于反應的起始量和轉化的程度,不能判斷是否達到平衡,故a錯誤;
b.NH3百分含量保持不變,說明反應達到平衡狀態,故b正確;
c.反應前后氣體的物質的量不等,容器中氣體的壓強不變,說明達到平衡狀態,故c正確;
d.NH3的生成速率與H2的消耗速率相等,正逆反應速率不等,沒有達到平衡狀態,故d錯誤;
e.由于氣體的質量不變,氣體物質的量反應前后不同,所以氣體的平均相對分子質量不變,說明反應物和生成物物質的量不變,反應達到平衡狀態,故e正確;
故答案為:bce.
點評 本題考查化學平衡的計算、平衡移動以及平衡狀態的判斷,題目難度中等,注意對圖象的分析.


科目:高中化學 來源: 題型:解答題
| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔點/℃ | 16.6 | -89.5 | -73.5 |
| 沸點/℃ | 117.9 | 117 | 126.3 |
| 密度/g•cm-3 | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 互溶 | 難溶 |

查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量 | 243 | 193 | 151 | 436 | 568 | 432 | 366 | 298 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 銅是還原劑,發生了氧化反應 | |
| B. | 每生成64 g SO2,轉移電子的物質的量是2 mol | |
| C. | 每消耗1 mol Cu,起氧化劑作用的硫酸消耗2 mol | |
| D. | 在此反應中,濃硫酸表現出酸性和氧化性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若甲為焦炭,則丁可能是O2 | B. | 若甲為SO2,則丁可能是氨水 | ||
| C. | 若甲為Fe,則丁可能是鹽酸 | D. | 若甲為NaOH溶液,則丁可能是CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
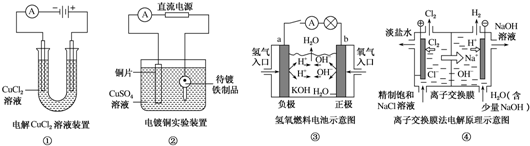
| A. | ①裝置中陰極處產生的氣體能夠使濕潤KI淀粉試紙變藍 | |
| B. | ②裝置中待鍍鐵制品應與電源正極相連 | |
| C. | ③裝置中電子由b極流向a極 | |
| D. | ④裝置中的離子交換膜可以避免生成的Cl2與NaOH溶液反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com