

| 試劑 | 沸點(℃) | 溶解度 | 化學性質 |
| 乙酸酐 | 139 | 在水中逐漸分解 | 略 |
| 乙酰水楊酸 | 略 | 微溶于水 | 與碳酸鈉反應生成水溶性鹽 |
| 水楊酸 | 211 | 微溶于冷水,易溶于熱水 | 略 |
| 乙酸 | 117.9 | 略 | 略 |
 .
. .
.分析 (1)根據水楊酸的結構簡式可知,水楊酸中有羧基,羧基能與碳酸氫鈉溶液反應產生二氧化碳;
(2)根據水楊酸的結構簡式可知,水楊酸中的羧基和酚羥基都能與足量碳酸鈉溶液反應,據此答題;
(3)圖2中試管用水浴加熱,所以流程(1)裝置圖中長導管可以冷凝回流和平衡壓強的作用;
(4)乙酸酐水解能生成乙酸,根據題中提供信息可知,乙酸易揮發,并保持適度的反應速率,據此控制反應溫度;
(5)流程(2)中晶體析出時表面有可能有硫酸根離子,所以判斷洗滌干凈的操作方法就是檢驗洗滌液中是否含有硫酸根離子;
(6)能使FeCl3溶液呈淺紫色的是酚羥基;
(7)乙酰水楊酸中的酯基、羧基與氫氧化鈉都能反應,且乙酰水楊酸中的酯基水解后生成酚羥基也能與氫氧化鈉反應,據此答題;
(8)根據圖1中信息可知,1mol水楊酸生成1mol乙酰水楊酸,據此計算2g水楊酸理論上產生乙酰水楊酸的質量,根據的產率為$\frac{實際產量}{理論產量}$×100%計算.
解答 解:(1)根據水楊酸的結構簡式可知,水楊酸中有羧基,羧基能與碳酸氫鈉溶液反應產生二氧化碳,所以水楊酸與碳酸氫鈉溶液反應的化學反應方程式為 ,
,
故答案為: ;
;
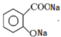
(2)根據水楊酸的結構簡式可知,水楊酸中的羧基和酚羥基都能與足量碳酸鈉溶液反應,所以水楊酸與足量碳酸鈉溶液反應后含苯環的生成物的結構簡式為 ,
,
故答案為: ;
;
(3)圖2中試管用水浴加熱,所以流程(1)裝置圖中長導管可以冷凝回流和平衡壓強的作用,
故答案為:冷凝回流和平衡壓強;
(4)乙酸酐水解能生成乙酸,根據題中提供信息可知,乙酸易揮發,并保持適度的反應速率,所以控制反應溫度為85℃~90℃可以既保持有較高的反應速率又減少物質的揮發,
故答案為:既保持有較高的反應速率又減少物質的揮發;
(5)流程(2)中晶體析出時表面有可能有硫酸根離子,所以判斷洗滌干凈的操作方法是取最后一次洗滌濾液少許于試管中,滴加少量氯化鋇,再滴加稀鹽酸,若無沉淀出現則洗滌干凈,反之則未洗滌干凈,
故答案為:取最后一次洗滌濾液少許于試管中,滴加少量氯化鋇,再滴加稀鹽酸,若無沉淀出現則洗滌干凈,反之則未洗滌干凈;
(6)能使FeCl3溶液呈淺紫色的是酚羥基,所以流程(4)中溶液顯紫色,說明產品中仍然可能有水楊酸,
故答案為:產品中仍然可能有水楊酸;
(7)乙酰水楊酸中的酯基、羧基與氫氧化鈉都能反應,且乙酰水楊酸中的酯基水解后生成酚羥基也能與氫氧化鈉反應,所以1mol乙酰水楊酸與氫氧化鈉溶液反應可能,最多消耗3mol NaOH,
故答案為:3;
(8)根據圖1中信息可知,1mol水楊酸生成1mol乙酰水楊酸,所以2g水楊酸理論上產生乙酰水楊酸的質量為$\frac{180}{138}$×2g=2.61g,所以乙酰水楊酸的產率為$\frac{實際產量}{理論產量}$×100%=$\frac{1.8g}{2.61g}$×100%=69%,
故答案為:69%.
點評 本題考查有機物制備實驗方案,涉及對操作及條件控制的分析評價、洗滌、物質的分離提純、產率計算等,側重考查學生對知識的遷移運用、分析解決問題的能力,難度中等.


科目:高中化學 來源: 題型:填空題


查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 僅①③ | B. | 僅②④ | C. | 僅①③④ | D. | 僅①②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在pH=0的溶液中:Fe2+、Mg2+、SO42-、NO3- | |
| B. | 能使淀粉碘化鉀試紙顯藍色的溶液:K+、SO42-、S2-、SO32- | |
| C. | 常溫下c(H+)/c(OH-)=1012的溶液:Fe3+、Mg2+、NO3-、Cl- | |
| D. | 不能使酚酞變紅的無色溶液:Na+、CO32-、K+、ClO-、AlO2- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 現象或事實 | 解釋 |
| A | 用熱的純堿溶液洗去油污 | Na2CO3可直接和油污反應 |
| B | 漂白粉在空氣中久置變質 | 漂白粉中的CaCl2與空氣中的CO2反應生成CaCO3 |
| C | 施肥時,草木灰(有效成分為K2CO3)不能與NH4Cl混合使用 | K2CO3與NH4Cl在土壤中反應生成氨氣會降低肥效 |
| D | 鋼鐵在潮濕的空氣中容易生銹 | 鋼鐵在空氣中發生了析氫腐蝕 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 鈉與水反應:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 用氯化鐵溶液和沸水反應制取氫氧化鐵膠體:Fe3++3H2O(沸水)═Fe(OH)3↓+3H+ | |
| D. | 漂白粉溶液在空氣中失效:ClO-+CO2+H2O═HClO+HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 類鉛元素原子的最外層電子數為6 | B. | 其常見價態為+2、+3、+4 | ||
| C. | 它的金屬性比鉛強 | D. | 它的原子半徑比鉛小? |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學鍵 | H-H | N-H | N≡N |
| 鍵能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com