


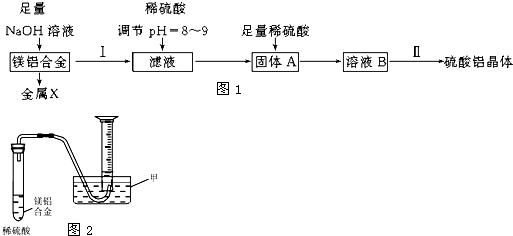
分析 濃縮海水中加入氯氣氧化溴離子得到溴水的混合物,利用熱的空氣吹出溴單質,得到粗溴,通入二氧化硫吸收溴單質發生氧化還原反應生成溴化氫,再通入氯氣氧化溴離子得到溴與水的溶液蒸餾得到液溴,
(1)進行步驟①的目的是通入氯氣氧化溴離子,應關閉bd,打開ac,進行反應和尾氣處理;
(2)步驟②是通入熱空氣把生成的溴單質趕出到裝置B,和通入的二氧化硫發生氧化還原反應,關閉ac,打開bd,依據氣泡冒出的個數判斷熱空氣的流速;
(3)步驟③中是二氧化硫和溴單質 發生氧化還原反應生成溴化氫和硫酸,簡單判斷反應完全的依據是溴水褪色;
(4)海水中溴元素較少,從“溴水混合物Ⅰ”到“溴水混合物Ⅱ”過程是富集溴元素;
(5)蒸餾裝置中溫度計是測定餾出成分的溫度,應是溫度計水銀球在蒸餾燒瓶的支管口處,燒瓶加熱面積較大,為均勻加熱應隔著石棉網加熱進行,冷凝裝置中的水流是逆流,裝置E是冷凝溴蒸氣,裝置F為吸收溴蒸氣防止污染空氣.
解答 解:濃縮海水中加入氯氣氧化溴離子得到溴水的混合物,利用熱的空氣吹出溴單質,得到粗溴,通入二氧化硫吸收溴單質發生氧化還原反應生成溴化氫,再通入氯氣氧化溴離子得到溴與水的溶液蒸餾得到液溴,
(1)進行步驟①的目的是通入氯氣氧化溴離子,且能使氯氣通入和濃縮海水中的溴離子反應,剩余氯氣進行尾氣吸收,應關閉bd,打開ac,進行反應和尾氣處理,
故答案為:bd;ac;
(2)步驟②是利用溴單質易揮發的性質,關閉ac,打開bd,通入熱空氣把生成的溴單質趕出到裝置B,和通入的二氧化硫發生氧化還原反應生成硫酸和溴化氫,依據氣泡冒出的個數判斷熱空氣的流速,A裝置中直玻璃管產生氣泡的快慢現象,簡單判斷熱空氣的流速,
故答案為:A裝置中直玻璃管產生氣泡的快慢;
(3)步驟③中是二氧化硫和溴單質發生氧化還原反應生成溴化氫和硫酸,簡單判斷反應完全的依據是溴水溶液的橙色變化為無色,溴水褪色,
故答案為:B中橙色剛好褪去;
(4)海水中溴元素較少,從“溴水混合物Ⅰ”到“溴水混合物Ⅱ”過程中,的目的是增大溴單質的濃度,富集溴元素,
故答案為:富集溴元素;
(5)蒸餾裝置中溫度計是測定餾出成分的溫度,蒸餾燒瓶中安裝溫度計,安裝其位置時應注意應是溫度計水銀球在蒸餾燒瓶的支管口處,燒瓶加熱面積較大,為均勻加熱應隔著石棉網加熱進行,冷凝裝置中的水流是逆流,冷凝水應從f進e出,裝置E是冷凝溴蒸氣得到液溴,裝置F中的氫氧化鈉溶液吸收溴蒸氣,防止污染空氣,
故答案為:溫度計水銀球位于支管口稍下的位置;f;冷凝揮發出的溴蒸氣;吸收Br2蒸氣,防止污染空氣;
點評 本題考查了物質制備的流程分析判斷,主要是海水提取溴的原理應用,實驗過程和實驗的注意問題是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖所示,已知兩瓶容積相同,同溫同壓下,左瓶內充滿氯化氫氣體,當右瓶中充滿下列混合氣體中的某一組時,其所含原子總數與左瓶中所含原子總數一定相等,則該混合氣體是( )
如圖所示,已知兩瓶容積相同,同溫同壓下,左瓶內充滿氯化氫氣體,當右瓶中充滿下列混合氣體中的某一組時,其所含原子總數與左瓶中所含原子總數一定相等,則該混合氣體是( )| A. | O3、N2 | B. | CH4、NH3 | C. | N2、O2 | D. | CO、CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:2 | B. | 2:l | C. | 3:2 | D. | 2:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,1.12 L CCl4含有C-Cl鍵的數目為0.2NA | |
| B. | 1 L 1 mol/L AlCl3溶液中含有NA個Al3+ | |
| C. | 常溫常壓下,4.4 g CO2與N2O的混合氣體中含有的原子總數為0.3NA | |
| D. | 80 mL 10 mol•L-1鹽酸與足量MnO2加熱反應,產生的Cl2分子數為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若已知上述反應為放熱反應,升高溫度,其平衡常數減小 | |
| B. | 上述反應中每生成1molSi3N4,轉移12mol電子 | |
| C. | 在氮化硅的合成反應中,N2是氧化劑,SiO2是還原劑 | |
| D. | 若使壓強增大,上述平衡向逆反應方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 所有的化學反應都有能量變化 | |
| B. | 需要加熱的反應一定是吸熱反應 | |
| C. | 所有的放熱反應都可以在常溫常壓下自發進行 | |
| D. | 核能作為一種反應熱,是理想的新能源 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 1:1:1 | B. | 2:1:1 | C. | 1:2:1 | D. | 1:1:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 試劑 | 沸點(℃) | 溶解度 | 化學性質 |
| 乙酸酐 | 139 | 在水中逐漸分解 | 略 |
| 乙酰水楊酸 | 略 | 微溶于水 | 與碳酸鈉反應生成水溶性鹽 |
| 水楊酸 | 211 | 微溶于冷水,易溶于熱水 | 略 |
| 乙酸 | 117.9 | 略 | 略 |
 .
.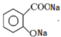 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com