
| 氫氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 開始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
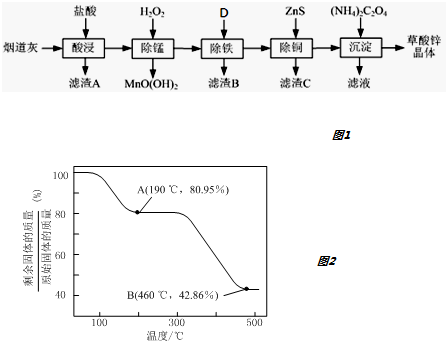
分析 鹽酸酸浸時SiO2不溶解,過濾分離,濾渣A為SiO2,濾液中加入過氧化氫進行除錳,再通過調節溶液pH,使Fe3+轉化為Fe(OH)3沉淀,過濾分離,濾液中再加入ZnS,Cu2+轉化為CuS沉淀,過濾除去,濾液中注意為氯化鋅,加入草酸銨得到草酸鋅晶體,最終的濾液中含有氯化銨等.
(1)由分析可知,濾渣A為二氧化硅,結合影響化學反應速率的因素解答;
(2)除錳過程中產生MnO(OH)2沉淀,根據電荷守恒應有氫離子生成;
(3)除雜使不能引入新雜質,可用含有鋅的氧化物、堿或碳酸鹽;流程不能顛倒,ZnS會將Fe3+還原為Fe2+,使鐵元素難以除去;
(4)用Na2C2O4代替(NH4)2C2O4生產草酸鋅晶體,可以吧草酸銨加入氯化鋅溶液中生成草酸鋅沉淀;
(5)ZnC2O4•2H2O晶體中的ZnC2O4質量分數為$\frac{153}{153+36}$×100%=80.95%,故A點完全失去結晶水,化學式為ZnC2O4,假設B點為ZnO,則殘留固體占有的質量分數為$\frac{81}{153+36}$×100%=42.86%,故B點殘留固體為ZnO,結合原子守恒可知還生成等物質的量的CO與CO2.
解答 解:(1)由分析可知,濾渣A為SiO2,為了提高浸出速率,除將煙道灰處理得更細外,還可采取的措施有適當增加鹽酸的濃度、提高反應溫度、攪拌等,
故答案為:SiO2;適當增加鹽酸的濃度、提高反應溫度、攪拌;
(2)除錳過程中產生MnO(OH)2沉淀,根據電荷守恒應有氫離子生成,反應離子方程式為:Mn2++H2O2+H2O=MnO(OH)2↓+2H+,
故答案為:Mn2++H2O2+H2O=MnO(OH)2↓+2H+;
(3)①除雜使不能引入新雜質,可用ZnO或ZnCO3或Zn(OH)2等,故答案為:ZnO或ZnCO3或Zn(OH)2;
②除鐵與除銅的順序不能顛倒,否則除鐵率會減小,其原因是:先加入ZnS會將Fe3+還原為Fe2+,使鐵元素難以除去,
故答案為:先加入ZnS會將Fe3+還原為Fe2+,使鐵元素難以除去;
(4)若沉淀過程采用Na2C2O4代替(NH4)2C2O4生產草酸鋅晶體,合理的加料方式是,在攪拌下,將Na2C2O4緩慢加入到ZnCl2溶液中,
故答案為:將Na2C2O4緩慢加入到ZnCl2溶液中,邊加邊攪拌;
(5)ZnC2O4•2H2O晶體中的ZnC2O4質量分數為$\frac{153}{153+36}$×100%=80.95%,故A點完全失去結晶水,化學式為ZnC2O4,假設B點為ZnO,則殘留固體占有的質量分數為$\frac{81}{153+36}$×100%=42.86%,故B點殘留固體為ZnO,結合原子守恒可知還生成等物質的量的CO與CO2.300℃~460℃范圍內,發生反應的化學方程式為:ZnC2O4$\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO↑+CO2↑,
故答案為:ZnC2O4$\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO↑+CO2↑.
點評 本題考查物質制備工藝流程,為高考常見題型,答題關鍵是對工藝流程的理解,涉及陌生方程式書寫、物質的分離提純、對條件的控制與分析、化學計算等,是對學生綜合能力的考查,是高考常考題目,熟練掌握元素化合物性質,題目難度中等


科目:高中化學 來源: 題型:選擇題
| A. | A2(g)+B2(g)?2AB(g)△H<0 | B. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | ||
| C. | W(g)?Z(g)△H<0 | D. | 2SO3(g)?2SO2(g)+O2(g)△H>0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氣體摩爾體積就是22.4 L/mol | |
| B. | 1 mol H2的質量只有在標況下才約為2 g | |
| C. | 標況下,18克H2O的體積為22.4 L | |
| D. | H2和O2的混合氣體1 mol在標況下的體積約為22.4 L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | AgCl不溶于水,不能轉化為AgI | |
| B. | 在含有濃度均為0.001 mol•L-1的Cl-、I-的溶液中緩慢加入AgNO3稀溶液,首先析出AgI沉淀 | |
| C. | AgI比AgCl更難溶于水,所以,AgCl可以轉化為AgI | |
| D. | 常溫下,AgCl若要在NaI溶液中開始轉化為AgI,則NaI的濃度必須不低于$\frac{1}{\sqrt{1.8}}$×10-11mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 +
+ $?_{△}^{濃H_{2}SO_{4}}$
$?_{△}^{濃H_{2}SO_{4}}$ +H2O
+H2O| 相對分子質量 | 密度/(g•cm-3) | 沸點/℃ | 水中溶解性 | |
| 異戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸異戊酯 | 130 | 0.8670 | 142 | 難溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 某學習小組擬以下列合成路線合成1-丁醇:
某學習小組擬以下列合成路線合成1-丁醇: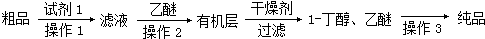
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 滴定次數 實驗數據 | 1 | 2 | 3 | 4 |
| V(樣品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初讀數) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(終讀數) | 14.98 | 15.20 | 15.12 | 15.95 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH>7 | B. | pH=7 | C. | pH<7 | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同溫同壓下,相同體積的物質,它們的物質的量必相等 | |
| B. | 1 L一氧化碳氣體一定比1 L氧氣的質量小 | |
| C. | 28 g N2和CO的混合氣體在標準狀況下的體積約為22.4 L | |
| D. | 常溫常壓下,1 mol碳完全燃燒消耗22.4 L氧氣 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com