
| A. | 第一電離能:Al<Mg | B. | 共價鍵極性:H-F<H-Cl | ||
| C. | 硬度:Al2O3<NaCl | D. | 酸性:H2SO4>H2SO3 |
分析 A.Mg的3s電子全滿,為穩定結構;
B.非金屬性越強,鍵的極性越強;
C.離子的電荷越大,半徑越小,則晶格能越大;
D.非羥基氧原子個數越多,酸性越強.
解答 解:A.Mg的3s電子全滿,為穩定結構,Mg難失去1個電子,則第一電離能:Al<Mg,故A正確;
B.非金屬性F>Cl,則共價鍵極性:H-F>H-Cl,故B錯誤;
C.離子的電荷越大,半徑越小,則晶格能越大,則硬度:Al2O3>NaCl,故C錯誤;
D.非羥基氧原子個數越多,酸性越強,硫酸、亞硫酸均為二元酸,非羥基氧原子數分別為2、1,則硫酸酸性強,故D正確;
故選AD.
點評 本題考查元素周期表和元素周期律的應用,為高頻考點,涉及第一電離能、晶格能判斷及酸性比較、極性比較等,注意結構與性質的關系是解答本題的關鍵,側重選修三知識點的考查,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題

| A. | D極電極反應:O2+4e-+4H+=2H2O | B. | E處通入H2,C處有O2放出 | ||
| C. | 甲池中陰極區只有苯被還原 | D. | 導線中共傳導14mol電子 |
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省長沙市高三上學期第三次月考模擬化學試卷 題型:選擇題
已知:Fe(OH)3和Al(OH)3沉淀的生成與溶解的量如下表。
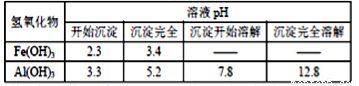
向FeCl3、Al2(SO4)3的混合溶液中逐有加入Ba(OH)2溶液,形成沉淀的情況如下圖所示.以下推斷錯誤的是
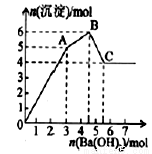
A.AB段可能發生的反應:2Ba2++3OH-+2SO42-+Al3+=2BaSO4↓+Al(OH)3↓
B.C點對應的沉淀:Fe(OH)3和BaSO4
C.OA段可能發生的反應:3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓
D.據圖計算原溶液中:c(Cl-)=c(SO42-)
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化學鍵 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C | Cl-Cl |
| 鍵能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 | 243 |
| A. | 表中最穩定的共價鍵是Si-Si | |
| B. | Cl2(g)→2 Cl(g):△H=-243 kJ•mol | |
| C. | H2 (g)+Cl2(g)=2HCl(g):△H=-183 kJ•mol | |
| D. | 根據表中數據能計算出SiCl4(g)+2 H2(g)=Si(s)+4 HCl(1)的△H |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH2=CHCH(CH3)CH2CH2CH2CH3 | B. | CH2=CHC(CH3)=CHCH2CH3 | ||
| C. | CH2=CHCH(CH3)C≡CH | D. | CH3CH2CH2CH2C(CH3)=CH2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
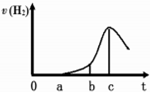 某興趣小組進行“活潑金屬與酸反應”的實驗.將5.4g的鋁片投入500mL0.5mol•L-1的硫酸溶液中,下圖為反應產生氫氣速率與反應時間的關系圖.
某興趣小組進行“活潑金屬與酸反應”的實驗.將5.4g的鋁片投入500mL0.5mol•L-1的硫酸溶液中,下圖為反應產生氫氣速率與反應時間的關系圖.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com