
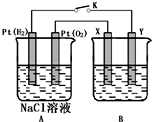
 某化學興趣小組用下圖所示裝置進行電化學原理的實驗探究,回答下列問題:
某化學興趣小組用下圖所示裝置進行電化學原理的實驗探究,回答下列問題:分析 (1)左邊是燃料電池,右邊是電解池,通氧氣的一極是正極發生還原反應,電極反應式為:O2+4e-+2H2O=4OH-;
(2)X與電源的正極相連,是陽極發生氧化反應,電解質溶液是硝酸銀溶液;
(3)粗銅中含有Zn、Fe、Ag、Au等雜質,其中鋅和鐵會在電極上放電生成陽離子進入溶液,所以陽極泥的主要成分是Ag、Au;
(4)電解飽和食鹽水陽極是氯離子失電子生成氯氣,陰極是氫離子得到電子生成氫氣;依據電解原理分析,書寫電池反應,依據生成的氣體體積,計算氫氧根離子濃度,結合離子積常數計算氫離子濃度計算溶液pH;恢復溶液濃度依據出什么,加什么的原則分析;
(5)X電極是陽極發生氧化反應,電極反應式為:2Cu+2OH--2e-=Cu2O+H2O;
(6)用Pt作電極,電解飽和硫酸鈉溶液時,陽極上氫氧根離子放電生成氧氣,陰極上氫離子放電生成氫氣,實際上是電解的水,發生總反應2H2O$\frac{\underline{\;通電\;}}{\;}$O2↑+2H2↑,電解水后,溶液中硫酸鈉過飽和導致析出晶體,剩余的電解質溶液仍是飽和溶液,析出的硫酸鈉晶體和電解的水組成的也是飽和溶液,根據質量分數公式計算即可;書寫電極方程式時要注意電極上發生的反應以及溶液的酸堿性.
解答 解:(1)A池是燃料電池,B池是電解池,通氧氣的一極是正極發生還原反應,電極反應式為:O2+4e-+2H2O=4OH-,
故答案為:正;O2+4e-+2H2O=4OH-;
(2)X與電源的正極相連,是陽極發生氧化反應,所以X電極材料為銀,電解質溶液是硝酸銀溶液,
故答案為:Ag;AgNO3溶液;
(3)粗銅中含有Zn、Fe、Ag、Au等雜質,其中鋅和鐵會在電極上放電生成陽離子進入溶液,所以陽極泥的主要成分是Ag、Au,
故答案為:Ag、Au;
(4)Y電極與原電池的負極相連,電極氫離子得到電子生成氫氣,生成氫氣560ml的物質的量=$\frac{0.56L}{22.4L/mol}$=0.025mol,依據電解方程式:
2Cl-+2H2O=H2↑+Cl2↑+2OH-;
1 2
0.025mol n
n=$\frac{0.025mol×2}{1}$=0.05mol
C(OH-)=$\frac{0.05mol}{0.5L}$=0.1mol/L,
C(H+)=10-13mol/L,pH=-lg[H+]=13;所以應加入0.025mol×2=0.05mol的HCl恢復原狀態,
故答案為:13;0.05molHCl;
(5)X電極是陽極發生氧化反應,電極反應式為:2Cu+2OH--2e-=Cu2O+H2O,
故答案為:2Cu+2OH--2e-=Cu2O+H2O;
(6)用Pt作電極,電解飽和硫酸鈉溶液時,陽極上氫氧根離子放電生成氧氣,陰極上氫離子放電生成氫氣,電解水后,溶液中硫酸鈉過飽和導致析出晶體,剩余的電解質溶液仍是飽和溶液,析出的硫酸鈉晶體和電解的水組成的也是飽和溶液,
N g Na2SO4•10H2O硫酸鈉的質量=Ng×$\frac{142}{322}$=$\frac{71N}{161}$g,
設電解水的質量為xg:
2H2O$\frac{\underline{\;通電\;}}{\;}$O2↑+2H2↑,
36g 2mol
x cmol
x=18cg
所以飽和溶液的質量分數=$\frac{\frac{71N}{161}}{N+18c}$×100%=$\frac{7100N}{161(N+18c)}$%;
書寫電極方程式時要根據正負極或陰陽極上參加反應的物質或離子書寫,同時要注意溶液的酸堿性對電極方程式的影響;
故答案為:$\frac{7100N}{161(N+18c)}$%;根據電極上發生的氧化或還原反應結合溶液的酸堿性書寫.
點評 本題考查原電池、電解池工作原理,正確推斷燃料電池正負極是解本題的關鍵,難點是溶液的pH計算和溶質的質量分數,根據電解飽和食鹽水的離子方程式分析解答,側重于考查學生的分析能力和計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 五種元素的原子半徑從大到小的順序是:Z>W>M>Y>X | |
| B. | 氫化物的還原性:Y>M>W | |
| C. | Y和M的氧化物都是酸性氧化物 | |
| D. | X2Z的電子式為: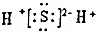 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溫度升高,三者都增大 | |
| B. | 室溫下Ka(HCN)<Ka(CH3COOH),說明CH3COOH的電離度一定比HCN大 | |
| C. | 2SO2(g)+O2(g)?2SO3(g)平衡后,僅增大壓強,平衡向右移動,但K值不變 | |
| D. | 化學平衡常數的大小與溫度、濃度、催化劑等有關 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 三氯生中含有氧氣分子 | |
| B. | 三氯生由碳、氫、氯、氧四種元素組成 | |
| C. | 三氯生是一種有機物 | |
| D. | 一個三氯生分子共含有24個原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H3的摩爾質量是3g | |
| B. | H3是氫元素的一種新的同位素 | |
| C. | H3分子中含有3個中子 | |
| D. | H2和H3是氫元素形成的兩種不同單質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原混合溶液中鉀離子濃度為2 mol/L | |
| B. | 上述電解過程中共轉移6摩爾電子 | |
| C. | 電解得到的銅的物質的量為0.5摩爾 | |
| D. | 電解后溶液中的pH=2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 二氧化氯(ClO2,黃綠色易溶于水的氣體)是高效、低毒的消毒劑.回答下列問題:
二氧化氯(ClO2,黃綠色易溶于水的氣體)是高效、低毒的消毒劑.回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com