
| A. | 五種元素的原子半徑從大到小的順序是:Z>W>M>Y>X | |
| B. | 氫化物的還原性:Y>M>W | |
| C. | Y和M的氧化物都是酸性氧化物 | |
| D. | X2Z的電子式為: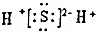 |
分析 X、Y、Z、W、M是短周期5種主族元素,X-與氦原子電子層結構相同,則X是H元素;Y原子的電子總數等于其電子層數的3倍,Y為C元素;Z的最高化合價為最低化合價絕對值的3倍,Z為S元素;W的單質可與鈉反應生成陰陽離子個數比為1:2的淡黃色固體化合物,則W為O元素;M的氫化物與其最高價氧化物的水化物可發生化合反應生成鹽,M為N元素,
A.元素原子電子層數越多其原子半徑越大,同一周期元素,原子半徑隨著原子序數增大而減小;
B.元素的非金屬性越弱,其氫化物的還原性越強;
C.Y、M是C、N元素,CO、NO是不成鹽氧化物;
D.H2S是共價化合物,每個H原子和S原子之間形成共價鍵.
解答 解:X、Y、Z、W、M是短周期5種主族元素,X-與氦原子電子層結構相同,則X是H元素;Y原子的電子總數等于其電子層數的3倍,Y為C元素;Z的最高化合價為最低化合價絕對值的3倍,Z為S元素;W的單質可與鈉反應生成陰陽離子個數比為1:2的淡黃色固體化合物,則W為O元素;M的氫化物與其最高價氧化物的水化物可發生化合反應生成鹽,M為N元素,
A.元素原子電子層數越多其原子半徑越大,同一周期元素,原子半徑隨著原子序數增大而減小,原子半徑大小順序是S>C>N>O>H,即Z>Y>M>W>X,故A錯誤;
B.元素的非金屬性越弱,其氫化物的還原性越強,非金屬性W>M>Y,所以氫化物的還原性W<M<Y,故B正確;
C.Y、M是C、N元素,CO、NO是不成鹽氧化物,故C錯誤;
D.H2S是共價化合物,每個H原子和S原子之間形成共價鍵,其電子式為 ,故D錯誤;
,故D錯誤;
故選B.
點評 本題考查原子結構和元素周期律的關系,為高頻考點,側重考查學生分析判斷能力,涉及元素周期律、化學鍵等知識點,明確元素周期表結構、原子結構及元素周期律性質是解本題關鍵,注意規律中的反常現象,易錯選項是C.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:填空題
 已知:反應I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
已知:反應I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1| 溫度/K | 反應I | 反應II | 已知: K2>K1 >K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 試管、蒸發皿既能用于給固體加熱也能用于給溶液加熱 | |
| B. | 分液漏斗既能用于某些混合物的分離也能用于組裝氣體發生裝置 | |
| C. | 堿式滴定管既可用于中和滴定,也可用于量取一定量的NaCl或AlCl3溶液 | |
| D. | 測量酒精沸點的實驗中,應使溫度計水銀球位于被加熱的酒精中 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 這種粒子中含有3個質子 | B. | 它的組成可用H3表示 | ||
| C. | 這種粒子中含有3個中子 | D. | 是氫的一種新的同位素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 300℃下,將2mol SO21mol O2混合于2L的恒容密閉容器中,發生反應:2SO2(g)+O2(g)?2SO3(g)△H,2分鐘末達到平衡,測得SO2的轉化率為60%,請根據化學反應的有關原理回答下列問題:
300℃下,將2mol SO21mol O2混合于2L的恒容密閉容器中,發生反應:2SO2(g)+O2(g)?2SO3(g)△H,2分鐘末達到平衡,測得SO2的轉化率為60%,請根據化學反應的有關原理回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
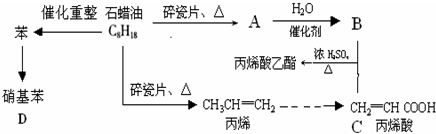
 A→B的反應類型:加成反應
A→B的反應類型:加成反應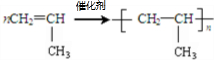 ;
;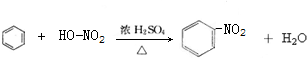 ,
,查看答案和解析>>
科目:高中化學 來源: 題型:解答題
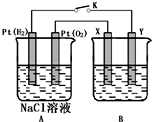 某化學興趣小組用下圖所示裝置進行電化學原理的實驗探究,回答下列問題:
某化學興趣小組用下圖所示裝置進行電化學原理的實驗探究,回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com