
| A. | 正反應速率與逆反應速率相等 | B. | 正反應速率與逆反應速率均為零 | ||
| C. | 反應物和生成物濃度相等 | D. | 反應停止了 |
分析 根據化學平衡狀態的特征解答,當反應達到平衡狀態時,正逆反應速率相等,各物質的濃度、百分含量不變,以及由此衍生的一些量也不發生變化,解題時要注意,選擇判斷的物理量,隨著反應的進行發生變化,當該物理量由變化到定值時,說明可逆反應到達平衡狀態.
解答 解:A、化學平衡是動態平衡,當反應達到平衡狀態時,正逆反應速率相等,故A正確;
B、化學平衡是動態平衡,當反應達到平衡狀態時,正逆反應速率相等,但不為0,故B錯誤;
C、當體系達平衡狀態時,正逆反應速率相等,反應物和生成物濃度不變,故C錯誤;
D、反應是動態平衡,正逆反應速率相等,但不為0,故D錯誤;
故選A.
點評 本題考查了化學平衡狀態的判斷,難度不大,注意當反應達到平衡狀態時,正逆反應速率相等,但不為0.


 狀元坊全程突破導練測系列答案
狀元坊全程突破導練測系列答案科目:高中化學 來源: 題型:解答題
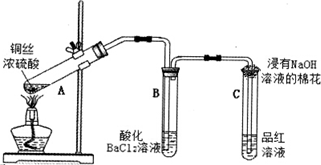
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2種 | B. | 3種 | C. | 4種 | D. | 5種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
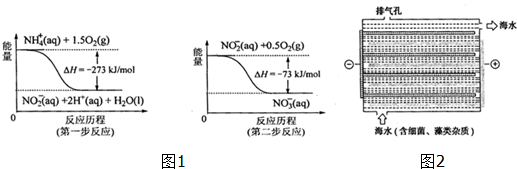
| 離子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 濃度(mol/L) | 3×10-6 | 7×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
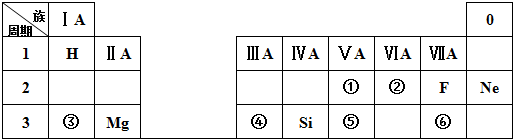
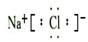 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
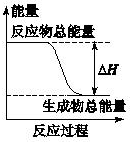
| A. | 由Zn和稀H2SO4反應制取氫氣 | B. | 灼熱的碳與二氧化碳反應 | ||
| C. | Ba(OH)2•8H2O晶體和NH4Cl晶體混合 | D. | 碳酸鈣的分解 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 0.1mol•L-1CH3COOH與0.1mol•L-1氨水等體積混合(PH=7):c(NH4+)=c(CH3COO-)=c(H+)=c(OH-) | |
| B. | 0.1mol•L-1HCl溶液與0.2mol•L-1氨水等體積混合(PH>7):c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-) | |
| C. | 0.1mol•L-1CH3COONa與0.1mol•L-1CaCl2溶液等體積混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 0.1mol•L-1Na2CO3溶液與0.1mol•L-1 NaHCO3溶液等體積混合:c(HCO3-)>0.05mol•L-1>c(CO32-)>c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加熱使c(H+)增大 | B. | 投入一小塊金屬鈉 | ||
| C. | 加入少量NH4Cl固體 | D. | 以鐵為電極進行電解 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com