


分析 提取CrO3的工藝流程:含Cr(Ⅵ)廢水A加入硫酸酸化,發生的反應為:2H++2CrO42-?CrO72-+H2O,該反應為可逆反應,所以B中含有CrO42-、Cr2O72-,加入亞硫酸氫鈉,+4價的硫被+6價的鉻氧化,反應為:3HSO3-+Cr2O72-+5H+=3SO42-+2Cr3++4H2O,得到溶液C,加入石灰乳,Cr3++Ca(OH)2=Cr(OH)3↓+Ca2+,氫氧化鉻煅燒干化得到氧化鉻,因硫酸鈣微溶,所以沉淀物中含有雜質CaSO4.
(1)根據可逆反應的特點分析;
(2)因Cr元素的化合價降低,則S元素的化合價升高為SO42-,根據得失電子守恒和元素守恒配平方程式;
(3)根據溶度積常數以及水的離子積常數來進行計算,清液的pH=5,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9,根據c(Cr3+)=$\frac{{K}_{SP}[Cr(OH)_{3}]}{{C}^{3}(0H)}$計算出鉻離子的濃度;
(4)硫酸鈣微溶,沉淀物中含有雜質CaSO4;
(5)①Cr2O72-具有強氧化性,可以將亞鐵離子氧化為鐵離子,自身被還原為Cr3+;
②根據酸性減弱,對化學平衡2H++2CrO42-?CrO72-+H2O的影響分析;
③控制PH使Cr(OH)3,完全沉淀,但不能使氫氧化鐵沉淀.
解答 解:(1)步聚I中,發生的反應為:2H++2CrO42-?CrO72-+H2O,該反應為可逆反應,可逆反應的特點為反應物和生成物共存,所以B中含有CrO42-、Cr2O72-,
故答案為:CrO42-、Cr2O72-;
(2)Cr元素的化合價從+6價降低到+3價得到3個電子,所以Cr2O72-→Cr3+得到6個電子;HSO3-→SO42-失去2個電子,所以Cr2O72-計量數是HSO3-的3倍,再根據原子守恒和電荷守恒配平其它物質的計量數;所以其方程式為3HSO3-+Cr2O72-+5H+=3SO42-+2Cr3++4H2O,
故答案為:3HSO3-+Cr2O72-+5H+=3SO42-+2Cr3++4H2O;
(3)清液的pH=5,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9,c(Cr3+)=$\frac{{K}_{SP}[Cr(OH)_{3}]}{{C}^{3}(0H)}$=$\frac{6.3×1{0}^{-31}}{(1{0}^{-9})^{3}}$=6.3×10-4mol/L;此時Cr3+的濃度=6.3×10-4mol/L×52g/mol≈327.6mg•L-1,
故答案為:327.6;
(4)溶液C,加入石灰乳,Cr3++Ca(OH)2=Cr(OH)3↓+Ca2+,氫氧化鉻煅燒干化得到氧化鉻,因硫酸鈣微溶,所以沉淀物中含有雜質CaSO4,
故答案為:CaSO4;
(5)①用FeSO4•7H2O作還原劑,發生反應6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,反應后的陽離子有Cr3+、Fe3+、H+,步驟Ⅲ中加入石灰乳,氫氧根離子和三價鉻形成氫氧化鉻沉淀,三價鐵和氫氧根離子形成氫氧化鐵沉淀,氫離子和堿中和,所以步驟Ⅲ中參加反應的陽離子一定有Cr3+、Fe3+、H+,
故答案為:Cr3+、Fe3+、H+;
②根據pH與c(Cr2O72-)的對應關系圖可知,pH=6時,C(H+)減小,化學平衡2H++2CrO42-?CrO72-+H2O向逆反應方向移動,溶液中Cr(Ⅵ)主要以CrO42-形式存在,所以該說法不正確,
故答案為:不正確,C(H+)減小,化學平衡2H++2CrO42-?CrO72-+H2O向逆反應方向移動,溶液中Cr(Ⅵ)主要以CrO42-形式存在;
③用鐵屑作還原劑時,為使所得產品中含鐵元素雜質的含量盡可能降低,需將溶液的PH控制在使Cr(OH)3,完全沉淀而氫氧化亞鐵不沉淀的范圍內,
故答案為:鐵屑過量,將溶液的PH控制在使Cr(OH)3,完全沉淀而氫氧化亞鐵不沉淀的范圍內.
點評 本題考查學生閱讀獲取信息的能力、常用化學用語、氧化還原滴定的應用等,側重于學生的分析能力、實驗能力和計算能力的考查,注意把握物質的性質以及反應流程,難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol/L稀硫酸100mL中含有硫酸根個數為0.1NA | |
| B. | 200mL 1mol/L Al2(SO4)3溶液中,Al3+和SO42-離子總數為NA | |
| C. | 2.4g金屬鎂與足量的鹽酸反應,轉移電子數為2 NA | |
| D. | 標準情況下,22.4LCl2和HCl的混合氣體中含分子總數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
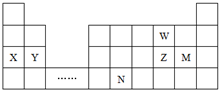
| A. | 原子半徑:Y>Z>W | |
| B. | 單質的還原性:X>Y | |
| C. | 溴與元素M同主族,最高價氧化物的水化物的酸性比M的強 | |
| D. | 元素N位于金屬與非金屬的分界線附近,可以推斷N元素的單質可作半導體材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
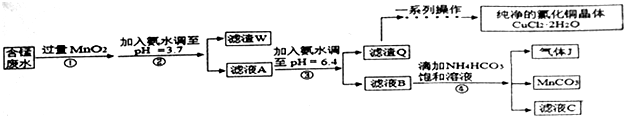
| 金屬離子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 開始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
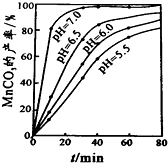
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com