
已知A、B、C、D、E、F是元素周期表中前36號元素,它們的原子序數依次增大。A的質子數、電子層數、最外層電子數均相等,B元素基態原子中電子占據三種能量不同的原子軌道且每種軌道中的電子總數相同,D的基態原子核外成對電子數是成單電子數的3倍,E4+與氬原子的核外電子排布相同,F是第四周期d區原子序數最大的元素。請回答下列問題:
(1)寫出E的價層電子排布式_____________________。
(2)A、B、C、D電負性由大到小的順序為__________(填元素符號)。
(3 )F(BD)4為無色揮發性劇毒液體,熔點-25℃ ,沸點43℃。不溶于水,易溶于乙醇、乙醚、苯等有機溶劑,呈四面體構型,該晶體的類型為 ___ ,F與BD之間的作用力為 ______ 。
)F(BD)4為無色揮發性劇毒液體,熔點-25℃ ,沸點43℃。不溶于水,易溶于乙醇、乙醚、苯等有機溶劑,呈四面體構型,該晶體的類型為 ___ ,F與BD之間的作用力為 ______ 。
(4)開發新型儲氫材料是氫能利用的重要研究方向。
①由A、B、E三種元素構成某種新型儲氫材料的理論結構模型如下圖1所示,圖中虛線框內B原子的雜化軌道類型有 ______ 種。

②分子X可以通過氫鍵形成“籠狀結構”而成為潛在的儲氫材料。X一定不是 _________ (填標號)。
A. H2O B. CH4 C. HF D. CO(NH2)2
③ F元素與鑭( La)元素的合金可做儲氫材料,該晶體的晶胞如上圖2所示,在晶胞中心有一個F原子,其他F原子都在晶胞面上,則該晶體的化學式為____ ;已知其摩爾質量為M g.mol-1 ,晶胞參數為a pm ,用NA表示阿伏加德羅常數,則該晶胞的密度為___________ g.cm-3。
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2016-2017學年浙江省高二上期中化學卷(解析版) 題型:填空題
室溫下,50 mL pH = 1的稀H2SO4和鹽酸的混合液與50 mL Ba(OH)2溶液相混合,充分反應后過濾,得0.466 g沉淀,濾液的pH值變為13。求:
(1)原混合液中SO42- 和Cl-的物質的量 ,
(2)Ba(OH)2溶液的物質的量濃度
查看答案和解析>>
科目:高中化學 來源:2016-2017學年云南省高二上期中化學卷(解析版) 題型:選擇題
下列說法正確的是( )
A. 在測定中和熱的實驗中, 為了準確測定反應混合溶液的溫度,實驗中溫度計水銀球應與小燒杯底部接觸
B. 酸堿中和滴定實驗中,錐形瓶要用待裝液預先潤洗
C. 在測定中和熱的實驗中,用0.5mol·L-1NaOH溶液分別與0.5 mol·L-1的鹽酸、醋酸溶液反應,如所取的溶液體積相等,則測得的中和熱數值相同
D. 測溶液PH值時,PH試紙不能潤濕
查看答案和解析>>
科目:高中化學 來源:2017屆寧夏高三上月考四化學試卷(解析版) 題型:填空題
【化學——選修物質結構與性質】
X是第四周期元素,最外層只有1個電子,次外層的所有原子軌道均充滿電子。元素Y基態原子的3p軌道上有2個未成對電子。元素Z 的原子最外層電子數是其內層的3倍。回答下列問題:
(1)元素X在元素周期表中位于 區,單質X的晶體類型為 ,其中X原子的配位數為 。
(2)已知元素Y可與元素Z的相對原子質量只差為16,則元素Y基態原子的外圍電子排布圖為 ,其同周期元素中,第一電離能最大的是________________(寫元素符號)。元素Y的含氧酸中,酸性最強的是_____________(寫化學式),該酸根離子的立體構型為_____________。
(3)Z的氫化物在乙醇中的溶解度大于Y的氫化物,其原因是 。
(4)X的氯化物與氨水反應可形成配合物[X(NH3)4]Cl2,1mol該配合物中含有σ鍵的數目為 。
(5)X與Y形成的一種化合物的立方晶胞如圖所示。
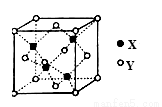
該化合物的化學式為_______________,已知此晶體的密度為ρg·cm–3,阿伏伽德羅常數為NA,則此晶胞中X與Y的最近距離是 cm。(寫出計算式,不要求計算結果。)
查看答案和解析>>
科目:高中化學 來源:2017屆寧夏高三上月考四化學試卷(解析版) 題型:選擇題
下列離子方程式書寫不正確的是
A.碳酸鈉與次氯酸反應:CO32-+2HClO=2ClO-+H2O+CO2↑
B.二氧化硫通入次氯酸鈉溶液中:SO2+ClO-+2OH-=SO42-+Cl-+H2O
C.明礬溶液中加氫氧化鋇溶液至硫酸根恰好沉淀完全:
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
D.碘化亞鐵溶液與少量氯氣反應:2I-+Cl2=I2+2Cl-
查看答案和解析>>
科目:高中化學 來源:2017屆內蒙古高三上月考四化學卷(解析版) 題型:選擇題
已知某種微生物燃料電池工作原理如圖所示。下列有關該電池的說法中,正確的是

A.外電路電子從B極移向A極[來
B.溶液中H+由B極區移向A極區
C.電池工作一段時間后B極區溶液的pH減小[
D.A極電極反應式為:CH3COOH - 8e-+ 2H2O = 2CO2 + 8H+
查看答案和解析>>
科目:高中化學 來源:2017屆遼寧省高三上模擬一化學試卷(解析版) 題型:填空題
工業上可以利用廢氣中的CO2為原料制取甲醇。請回答下列問題:
(1) 已知常溫常壓下,下列兩個可逆反應的能量變化如下圖所示:
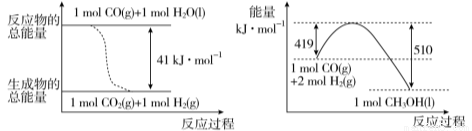
請寫出左圖反應的平衡常數表達式K= 。
請寫出由二氧化碳和氫氣制備甲醇的熱化學方程式 。
(2) 如果只改變一個條件使上述反應方程式的平衡常數K值變大,則該反應________(選填編號)。
A.一定向正反應方向移動 B.在平衡移動時,正反應速率先增大后減小
C.一定向逆反應方向移動 D.在平衡移動時,逆反應速率先減小后增大
(3) 在其他條件不變的情況下,將容器體積壓縮到原來的1/2,與原平衡相比,下列有關說法正確的是________(填字母)。
A.H2的濃度減小 B.正反應速率加快,逆反應速率也加快
C.甲醇的物質的量增加 D.重新平衡時,n(H2)/n(CH3OH)增大
(4) 保持溫度和體積不變,通入1molCO2和3molH2 ,下列能說明該反應已達平衡狀態的是________(填字母)。
,下列能說明該反應已達平衡狀態的是________(填字母)。
A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器內壓強保持不變
C.H2的消耗速率與CO2的消耗速率之比為3∶1
D.容器內氣體的平均相對分子質量保持不變
(5) 若反應容器的容積為2.0 L,反應時間4.0 min,容器 內氣體的密度減少了2.0 g·L-1。在這段時間內CO2的平均反應速率為_______________
內氣體的密度減少了2.0 g·L-1。在這段時間內CO2的平均反應速率為_______________
(6) 有人設計甲醇-空氣燃料電池電源, 用石墨作電極電解200 mL含有下列離子的溶液:
用石墨作電極電解200 mL含有下列離子的溶液:
離子 | Cu2+ | H+ | Cl- | SO |
c/(mol·L-1) | 0.5 | 2 | 2 | 0.5 |
電解一段時間后,標況下當兩極收集到相同體積的氣體時,陽極上收集到氧氣的質量為____________(忽略溶液體積的變化及電極產物可能存在的溶解現象)。也有人用此電源利用電解法制備Na2FeO4,陽極材料為鐵,其電解質溶液用NaOH溶液,陽極反應式為 。
查看答案和解析>>
科目:高中化學 來源:2017屆遼寧省高三上模擬一化學試卷(解析版) 題型:選擇題
下列離子在指定溶液中一定能大量共存的是
A.加入Al能放出H2的溶液中:Fe2+、K+、NO 、Cl-
、Cl-
B.在pH=13的溶液中:Na+、AlO2-、NO 、S2-、SO
、S2-、SO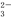
C.由水電離的c(H+)=10-12mol·L-1的溶液中:Cl-、NO 、NH
、NH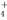 、F-
、F-
D.NaHCO3溶液中:K+、Na+、SO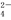 、Al3+
、Al3+
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省高三上學期期中化學卷(解析版) 題型:選擇題
設NA為阿伏加德羅常數的值,下列敘述正確的是( )
A.1 mol CH3+含電子數為10NA
B.1 mol Na2O和Na2O2混合物中含有的陰、陽離子總數是3NA
C.標準狀況下,22.4 L水中含有原子總數為3NA
D.1molCl2完全溶于水后,轉移的電子數為NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com