
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;元素⑩名稱為溴在周期表中的位置第四周期ⅤⅡA族.
;元素⑩名稱為溴在周期表中的位置第四周期ⅤⅡA族.分析 由元素在周期表中的位置可知,①為C,②為N,③為O,④為Na,⑤為Al,⑥為S,⑦為Cl,⑧為Ar,⑨為K,⑩為Br,
(1)在這些元素中,化學性質最不活潑的為稀有氣體元素Ar,元素⑩為Br;
(2)在最高價氧化物的水化物中,高氯酸的酸性最強,KOH的堿性最強;
(3)電子層越多,離子半徑越大,具有相同電子排布的離子中原子序數大的離子半徑小;
(4)氧化鋁為兩性氧化物,與NaOH反應生成偏鋁酸鈉和水;
(5)元素③的氫化物為水,元素⑦的單質為氯氣,二者反應生成鹽酸和HClO.
解答 解:由元素在周期表中的位置可知,①為C,②為N,③為O,④為Na,⑤為Al,⑥為S,⑦為Cl,⑧為Ar,⑨為K,⑩為Br,
(1)在這些元素中,化學性質最不活潑的為稀有氣體元素Ar,質子數為18,原子結構示意圖為 ,元素⑩為Br,名稱為溴,位于第四周期ⅤⅡA族,
,元素⑩為Br,名稱為溴,位于第四周期ⅤⅡA族,
故答案為:Ar; ;溴;第四周期ⅤⅡA族;
;溴;第四周期ⅤⅡA族;
(2)以上元素中最高價氧化物對應的水化物中酸性最強的為HClO4,堿性最強的為NaOH,故答案為:HClO4;NaOH;
(3)電子層越多,離子半徑越大,具有相同電子排布的離子中原子序數大的離子半徑小,離子半徑為S2->O2->Na+,故答案為:S2->O2->Na+;
(4)氧化鋁為兩性氧化物,與NaOH反應生成偏鋁酸鈉和水,離子反應為Al2O3+2OH-=2AlO2-+H2O,故答案為:Al2O3+2OH-=2AlO2-+H2O;
(5)元素③的氫化物為水,元素⑦的單質為氯氣,二者反應生成鹽酸和HClO,離子反應為Cl2+H2O=H++Cl-+HClO,故答案為:Cl2+H2O=H++Cl-+HClO.
點評 本題考查位置、結構、性質,為高頻考點,把握元素的位置、性質、元素化合物知識為解答的關鍵,側重分析與應用能力的考查,注意氧化鋁為兩性氧化物,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
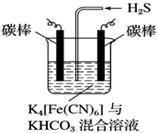 鐵及其化合物在工農業生產、環境保護等領域中有著重要的作用.
鐵及其化合物在工農業生產、環境保護等領域中有著重要的作用.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 晶體 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3 401 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該化合物僅含碳、氫兩種元素 | B. | 該化合物中碳、氫原子個數比為1:4 | ||
| C. | 無法確定該化合物是否含有氧元素 | D. | 該化合物中一定不含有氧元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
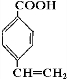 .
.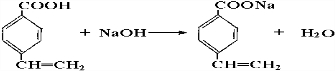 .
.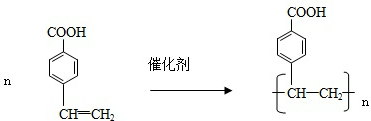 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 聯堿法對母液的處理方法是向母液中通入二氧化碳,冰凍和加食鹽 | |
| B. | 列管式熱交換器的使用實現了原料的充分利用 | |
| C. | 焙燒辰砂制取汞的反應原理為:HgS+O2$\stackrel{焙燒}{→}$Hg+SO2 | |
| D. | 氯堿工業、鋁的冶煉、犧牲陽極的陰極保護法都是應用了電解池的原理 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
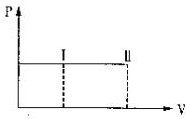 一帶有活塞的密封容器中盛有A、B組成的混合氣體,在通常條件下,從狀態I反應到狀態II時,氣體體積(V)與氣體壓強(P)的變化曲線如圖所示.
一帶有活塞的密封容器中盛有A、B組成的混合氣體,在通常條件下,從狀態I反應到狀態II時,氣體體積(V)與氣體壓強(P)的變化曲線如圖所示.| A. | 是放熱反應 | |
| B. | 反應后氣體總分子數增多 | |
| C. | 是吸熱反應 | |
| D. | 反應物具有的總能量等于生成物具有的總能量 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com