
 化學與人類社會可持續發展密切相關,能源、環境、材料以及日常生活等離不開化學.
化學與人類社會可持續發展密切相關,能源、環境、材料以及日常生活等離不開化學.分析 (1)硅酸鹽由鹽的書寫改寫為氧化物的形式為:活潑金屬氧化物•較活潑金屬氧化物•二氧化硅•水的順序書寫;氯氣與氫氧化鈉反應制備漂白液;
(2)硫酸亞鐵易被氧氣氧化;酸性條件下,亞鐵離子與氧氣反應生成鐵離子和水;高錳酸鉀與亞鐵離子反應,高錳酸鉀褪色;
(3)從經濟角度分析,制取等量的硫酸銅時,所用的原料最少且最便宜的成本最低;從環境保護的角度出發,在制取硫酸銅時最好不要對環境造成污染;
(4)MgO與碳粉和氯氣在一定條件下反應可制備MgCl2,反應產物為二氧化碳,若尾氣可用足量NaOH溶液完全吸收是氯氣、二氧化碳和氫氧化鈉反應的產物;
(5)CuSO4溶液能用作P4中毒的解毒劑,反應生成磷酸和銅;
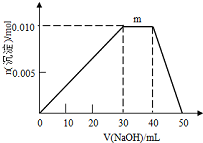
(6)①N點過程中加入氫氧化鈉,沉淀物質的量不變,是NH4+與OH-反應生成NH3•H2O;
②根據n=cV計算n(Al3+ )、n(NH4+)、n(SO42-)、n(Ba2+)、n(OH-),根據SO42-、Ba2+中不足量的離子的物質的量計算生成BaSO4的物質的量,依次發生:Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3•H2O、Al(OH)3+OH-=AlO2-+2H2O,根據方程式計算生成Al(OH)3的物質的量,進而二者計算生成固體總物質的量.
解答 解:(1)硅酸鹽由鹽的書寫改寫為氧化物的形式為:活潑金屬氧化物•較活潑金屬氧化物•二氧化硅•水的順序書寫,則Na2CaSi6O14,以氧化物形式可表示為Na2O•CaO•6SiO2;氯氣與氫氧化鈉反應制備漂白液,氯氣反應生成NaClO和NaCl、水;
故答案為:Na2O•CaO•6SiO2;NaClO和NaCl;
(2)亞鐵易被氧化,當用硫酸亞鐵制成藥片時外表要包有一層特殊的糖衣,這層糖衣的作用是防止Fe2+被氧化;酸性條件下,亞鐵離子與氧氣反應生成鐵離子和水,其反應的離子方程式為:4Fe2++O2+4H+=4Fe3++2H2O;高錳酸鉀與亞鐵離子反應,高錳酸鉀褪色,其反應的離子方程式為:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;
故答案為:防止Fe2+被氧化;4Fe2++O2+4H+=4Fe3++2H2O;MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;
(3)A.銅和濃硫酸反應的方程式為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2 ↑+2H2O,該反應中產生有毒氣體二氧化硫,所以對環境有污染,不符合“綠色化學”理念,且硫酸的利用率不高,故A錯誤.
B.銅和稀硫酸不發生反應,不能制得硫酸銅,故B錯誤.
C.氧化銅和硫酸反應的方程式為:CuO+H2SO4=CuSO4+H2O,沒有污染物,且硫酸的利用率100%,符合“綠色化學”和“降低成本”理念,故C正確.
D.銅與Fe(SO4)3溶液反應反應方程式為:Cu+2Fe(SO4)3=CuCl2+2FeCl2,該反應雖有硝酸銅生成,但同時生成氯化銅,不能得到純凈硫酸銅,故D錯誤.
故答案為:C;
(4)MgO與碳粉和氯氣在一定條件下反應可制備MgCl2,反應化學方程式:2MgO+C+2Cl2=CO2+2MgCl2,反應產物為二氧化碳,若尾氣可用足量NaOH溶液完全吸收是氯氣、二氧化碳和氫氧化鈉反應的產物,反應的化學方程式為:CO2+2NaOH=Na2CO3+H2O,Cl2+2NaOH=NaCl+NaClO+H2O,產物為NaCl,NaClO,Na2CO3 ;
故答案為:2MgO+C+2Cl2=CO2+2MgCl2;NaCl,NaClO,Na2CO3 ;
(5)CuSO4溶液能用作P4中毒的解毒劑,反應生成磷酸和銅,該反應的化學方程式是:P4+10CuSO4+16H2O=10Cu+4H3PO4+10H2SO4,
故答案為:P4+10CuSO4+16H2O=10Cu+4H3PO4+10H2SO4;
(6)①N點過程中加入氫氧化鈉,沉淀物質的量不變,是NH4+與OH-反應生成NH3•H2O,離子方程式為:NH4++OH-=NH3•H2O,
故答案為:NH4++OH-=NH3•H2O;
②10mL 1mol•L-1 NH4Al(SO4)2溶液中Al3+ 物質的量為0.01mol,NH4+的物質的量為0.01mol,SO42-的物質的量為0.02mol,20mL 1.2 mol•L-1Ba(OH)2溶液中Ba2+物質的量為0.024mol,OH-為0.048mol,
由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
Al3++3OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反應剩余OH-為0.048mol-0.03mol=0.018mol,
NH4++OH-=NH3•H2O
0.01mol 0.01mol
反應剩余OH-為0.018mol-0.01mol=0.008mol,
Al(OH)3+OH-=AlO2-+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀為0.01mol-0.008mol=0.002mol
則最終得到固體為0.02mol+0.002mol=0.022mol,
故答案為:0.022.
點評 本題考查核了硅酸鹽、氧化還原反應、元素化合物的性質、物質的制備工藝、化學圖象及化學計算,是對學生綜合能力的考查,需要學生具備扎實的基礎,難度中等.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 常溫下有0.1mol•L-1五種溶液NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4.
常溫下有0.1mol•L-1五種溶液NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NF3分子呈三角錐形 | |
| B. | NF3分子是極性分子 | |
| C. | NF3與NH3晶體類型相同 | |
| D. | 上述反應的反應物和生成物均屬于共價分子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | PbCO3 | B. | SnCO3•Sn(OH)2 | C. | 2PbCO3•Pb(OH)2 | D. | (CH3COO)2Pb |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 有的共價化合物在液態時也能導電 | |
| B. | 含有離子鍵的化合物中,也可能還含有共價鍵 | |
| C. | 形成離子鍵的微粒必須是金屬陽離子與陰離子 | |
| D. | 非金屬元素形成的化合物一定不存在離子鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯化銨固體 | B. | 硫酸 | C. | NaOH固體 | D. | 大量水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某有機物燃燒只生成CO2和H2O,且二者物質的量相等,則此有機物的組成為CnH2n | |
| B. | 一種烴在足量的氧氣中燃燒并通過堿石灰,減少的體積就是生成水蒸氣的體積 | |
| C. | 某氣態烴CxHy與足量O2恰好完全反應,如果反應前后氣體體積不變(溫度>100℃),則y=4,若體積減少,則y>4,否則y<4 | |
| D. | 相同質量的烴,完全燃燒,消耗的O2越多,則烴中氫元素的百分含量越高 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com