
| A. | 用惰性電極電解一定濃度的硫酸銅溶液,一段時間后,加入0.1molCu(OH)2后恰好恢復到電解前的濃度和pH,則電解過程中轉移電子數為0.4mol | |
| B. | 磷酸的電離方程式為:H3PO4=H++H2PO4- | |
| C. | 電鍍時保持電流恒定,升溫可知加快反應速率 | |
| D. | 反應NH3(g)+HCl(g)═NH4Cl(s)在室溫下可自發進行,則該反應的△H>0 |
分析 A.惰性電極電解一定濃度的硫酸銅溶液,一段時間后,加入0.1molCu(OH)2后恰好恢復到電解前的濃度和pH,說明該電解過程中相當于析出CuO和H2O,則陽極上只有氫氧根離子放電生成氧氣,根據氧氣和轉移電子之間的關系式計算;
B.磷酸是中強酸,在水溶液中部分電離;
C.電鍍時保持電流恒定,即單位時間內轉移的電子數恒定,則消耗的反應物與產生的生成物的量恒定,也就是反應速率恒定;
D.如果△G=△H-T△S<0,該反應能自發進行.
解答 解:A.惰性電極電解一定濃度的硫酸銅溶液,一段時間后,加入0.1molCu(OH)2后恰好恢復到電解前的濃度和pH,說明該電解過程中相當于析出CuO和H2O,則陽極上只有氫氧根離子放電生成氧氣,根據O元素和轉移電子之間的關系式得轉移電子的物質的量=0.1mol×2×2=0.4mol,故A正確;
B.磷酸是中強酸,在水溶液中部分電離,電離方程式應該寫“?”,電離方程式為H3PO4?H++H2PO4-,故B錯誤;
C.電鍍時保持電流恒定,即單位時間內轉移的電子數恒定,則消耗的反應物與產生的生成物的量恒定,也就是反應速率恒定,與溫度無關,故C錯誤;
D.如果△G=△H-T△S<0,該反應能自發進行,該反應為熵減,則△S<0,要使△G=△H-T△S<0,則該反應的△H<0,故D錯誤;
故選A.
點評 本題考查原電池和電解池原理、反應自發性的判斷、弱電解質的電離等知識點,側重考查分析計算能力,易錯選項是AC,注意A中陰極上不僅析出Cu還析出氫氣,C中反應速率與溫度無關,題目難度中等.


 期末集結號系列答案
期末集結號系列答案科目:高中化學 來源: 題型:選擇題
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HC1 | B. | 2CH3CH2OH+02$\stackrel{Cu、△}{→}$2CH3CH0+2H20 | ||
| C. | 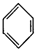 +HNO3$→_{50-60℃}^{濃硫酸}$ +HNO3$→_{50-60℃}^{濃硫酸}$ +H2O +H2O | D. | nCH2=CH2$\stackrel{一定條件}{→}$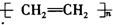 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
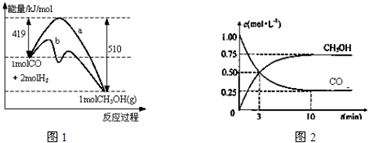
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
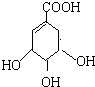 莽草酸是合成治療禽流感的藥物--達菲(Tamiflu)的原料之一.莽草酸是A的一種異構體.A的結構簡式如圖:
莽草酸是合成治療禽流感的藥物--達菲(Tamiflu)的原料之一.莽草酸是A的一種異構體.A的結構簡式如圖: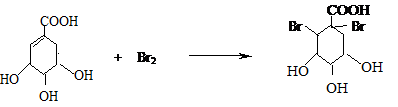 .
.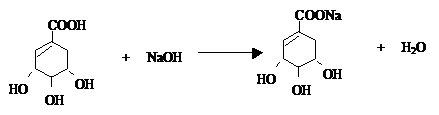 .
.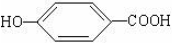 ),其反應類型消去反應.
),其反應類型消去反應.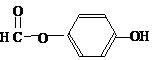 或
或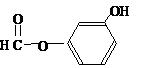 或
或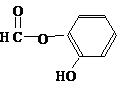 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
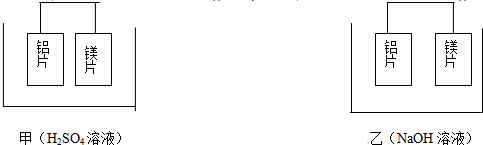
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
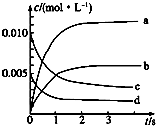 在2L密閉容器內,800℃時反應2NO(g)+O2(g)═2NO2(g)體系中,n(NO)隨時間的變化如下表:
在2L密閉容器內,800℃時反應2NO(g)+O2(g)═2NO2(g)體系中,n(NO)隨時間的變化如下表:| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向KAl(SO4)2溶液中加入Ba(OH)2至SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| B. | 偏鋁酸鈉溶液中加過量HCl:AlO2-+4H+=Al3++H2O | |
| C. | 向NH4HSO3溶液中滴入適量NaOH溶液:HSO3-+OH-=SO32-+H2O | |
| D. | 電鍍銅時陽極反應為:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 依據丁達爾現象可將分散系劃分為溶液、膠體與濁液 | |
| B. | PM2.5(微粒直徑約為2.5×10-6 m)分散在空氣中形成氣溶膠 | |
| C. | 光導纖維、聚乙烯、油脂都是高分子化合物 | |
| D. | 大霧的形成與汽車的尾氣排放有很大關系 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com